Gases nobles
Los gases nobles son un grupo de elementos químicos con propiedades muy similares: por ejemplo, bajo condiciones normales, son gases monoatómicos inodoros, incoloros y presentan una reactividad química muy baja. Se sitúan en el grupo 18 (VIIIA)[1]de la tabla periódica (anteriormente llamado grupo 0). Los siete gases son helio (He), neón (Ne), argón (Ar), kriptón (Kr), xenón (Xe), el radiactivo radón (Rn)[1] y el sintético oganesón (Og).

Las propiedades de los gases nobles pueden ser explicadas por las teorías modernas de la estructura atómica: a su capa electrónica de electrones valentes se la considera completa,[2] dándoles poca tendencia a participar en reacciones químicas, por lo que solo unos pocos compuestos de gases nobles han sido preparados hasta 2008. El xenón reacciona de manera espontánea con el flúor (debido a la alta electronegatividad de este), y a partir de los compuestos resultantes se han alcanzado otros. También se han aislado algunos compuestos con kriptón. Los puntos de fusión y de ebullición de cada gas noble están muy próximos, difiriendo en menos de 10 °C; consecuentemente, solo son líquidos en un rango muy pequeño de temperaturas.
El neón, argón, kriptón y xenón se obtienen del aire[3] usando los métodos de licuefacción y destilación fraccionada.[4] El helio es típicamente separado del gas natural y el radón se aísla normalmente a partir del decaimiento radioactivo de compuestos disueltos del radio. Los gases nobles tienen muchas aplicaciones importantes en industrias como iluminación, soldadura y exploración espacial. La combinación helio-oxígeno-nitrógeno (trimix) se emplea para respirar en inmersiones de profundidad para evitar que los buzos sufran el efecto narcótico del nitrógeno. Después de verse los riesgos causados por la inflamabilidad del hidrógeno, este fue reemplazado por helio en los dirigibles y globos aerostáticos.
Historia
Gas noble es una traducción del nombre alemán Edelgas, usado por primera vez en 1898 por Hugo Erdmann,[5] para indicar su extremadamente bajo nivel de reactividad. El nombre hace una analogía con el término «metales nobles», como el oro, asociado con riqueza y nobleza, y que tiene también una baja reactividad. También se ha dado a los gases nobles el nombre gases inertes, pero esta etiqueta ha sido desaprobada a medida que los gases nobles se han ido conociendo más.[6] Gases raros es otro término que se ha utilizado,[7] pero también es incorrecto porque el argón conforma una parte bastante considerable (0,94 % por volumen, 1,3 % por masa) de la atmósfera terrestre.[8]
Pierre Janssen y Joseph Norman Lockyer fueron los primeros en descubrir un gas noble el 18 de agosto de 1868 cuando examinaban la cromosfera del Sol, y lo llamaron helio a partir de la palabra griega para el Sol, ἥλιος (helios).[9] Anteriormente, en 1784, el químico y físico inglés Henry Cavendish había descubierto que el aire contenía una pequeña proporción de una sustancia menos reactiva que el nitrógeno.[10] Un siglo más tarde, en 1895, lord Rayleigh descubrió que las muestras de nitrógeno del aire son de diferente densidad que las del nitrógeno como consecuencia de reacciones químicas. En colaboración con William Ramsay, científico del University College de Londres, Lord Rayleigh postuló que el nitrógeno extraído del aire se encontraba mezclado con otro gas y ejecutó un experimento que consiguió aislar exitosamente un nuevo elemento: el argón, palabra derivada del griego ἀργός (argós), "inactivo".[10] A partir de este descubrimiento, notaron que faltaba una clase completa de gases en la tabla periódica. Durante su búsqueda del argón, Ramsay también consiguió aislar el helio por primera vez, al calentar cleveíta, un mineral. En 1902, después de aceptar la evidencia de la existencia de los elementos helio y argón, Dmitri Mendeléyev incluyó estos gases nobles como Grupo 0 en su clasificación de elementos, que posteriormente se convertiría en la tabla periódica.[11]
Ramsay continuó con la búsqueda de estos gases usando el método de la destilación fraccionada para separar aire líquido en varios componentes. En 1898, descubrió el kriptón, el neón y el xenón, llamados así a partir del griego κρυπτός (kryptós, "oculto"), νέος (néos, "nuevo"), y ξένος (xénos, "extraño"), respectivamente. Por su parte, el radón fue identificado por primera vez en 1898 por Friedrich Ernst Dorn,[12] y se le llamó emanación de radio, pero no fue considerado como un gas noble hasta 1904, cuando se determinó que sus características eran similares a las de los otros gases nobles.[13] Ese mismo año, Rayleigh y Ramsay recibieron el Premio Nobel de Física y Química, respectivamente, por el descubrimiento de los gases nobles.[14][15]
El descubrimiento de los gases nobles ayudó a la compresión de la estructura atómica. En 1895, el químico francés Heri Moissan intentó infructuosamente producir una reacción entre el flúor, el elemento más electronegativo, y el argón, uno de los gases nobles, con el fin de aislar de la atmósfera aquellos gases caracterizados por su extraordinaria inercia química, comenzando por el que está en mayor abundancia relativa, y de crear nuevos elementos o compuestos.[16][17] Los científicos fueron incapaces de producir compuestos de argón hasta fines del siglo XX, pero sus intentos ayudaron a desarrollar nuevas teorías de la estructura atómica. Basándose en estos experimentos, el físico danés Niels Bohr propuso en 1913 que los electrones en los átomos se encontraban ordenados en capas electrónicas en torno al núcleo y que en el caso de los gases nobles, exceptuando al helio, la capa exterior siempre contenía ocho electrones.[13] En 1916, Gilbert N. Lewis formuló la regla del octeto, la cual concluye que la configuración más estable para cualquier átomo es contar con ocho electrones en la capa exterior; esta configuración produce elementos que no reaccionan con otros, ya que no necesitan más electrones para completar su capa exterior.[18]
En 1962 Neil Bartlett descubrió el primer compuesto químico de un gas noble, el hexafluoroplatinato de xenón.[19] Compuestos de otros gases nobles fueron descubiertos poco después: en 1962, el fluoruro de radón,[20] y en 1963, el difluoruro de kriptón (KrF2).[21] El primer compuesto estable de argón se reportó en 2000 cuando se formó el fluorohidruro de argón a una temperatura de 40 K (−233,2 °C; −387,7 °F).[22]
En diciembre de 1998, científicos del Joint Institute for Nuclear Research trabajando en Dubna, Rusia, bombardearon plutonio (Pu) con calcio (Ca) para producir un único átomo del elemento 114,[23] bajo el nombre Flerovio (Fl).[24] Experimentos químicos preliminares indican que este elemento puede ser el primer elemento transuránico en mostrar propiedades anormales y parecidas a las de los gases nobles, aun cuando es miembro del grupo 14 en la tabla periódica.[25] En octubre de 2006, científicos del Joint Institute for Nuclear Research y del Lawrence Livermore National Laboratory sintetizaron exitosamente el oganesson (Og), el séptimo elemento en el Grupo 18,[26] al bombardear californio (Cf) con calcio (Ca).[27] Como curiosidad cabe indicar que la discusión científica sobre la posibilidad de licuar estos gases dio lugar al descubrimiento de la superconductividad por el físico neerlandés Heike Kamerlingh Onnes.
Propiedades físicas y atómicas
| Propiedad | Gas noble | ||||||
|---|---|---|---|---|---|---|---|
| Número atómico | 2 | 10 | 18 | 36 | 54 | 86 | 118 |
| Nombre del elemento | Helio | Neón | Argón | Kriptón | Xenón | Radón | Oganesón |
| Densidad (kg/m³) | 0,1785 | 0,9002 | 1,7818 | 3,708 | 5,851 | 9,970 | 13,65 |
| Radio atómico (nm) | 0,050 | 0,070 | 0,094 | 0,109 | 0,130 | 0,152 | — |
| Punto de ebullición (°C) | –268,83 | –245,92 | –185,81 | –151,70 | –106,60 | –62 | 380 |
| Punto de fusión (°C) | –272 | –248,52 | –189,6 | –157 | –111,5 | –71 | |
Los gases nobles cuentan con fuerzas intermoleculares muy débiles y, por lo tanto, tienen puntos de fusión y de ebullición muy bajos. Todos ellos son gases monoatómicos bajo condiciones estándar, incluyendo aquellos que tienen masas atómicas mayores que algunos elementos que se encuentran normalmente en estado sólido. El helio tiene varias propiedades únicas con respecto a otros elementos: tanto su punto de ebullición como el de fusión son menores que los de cualquier otra sustancia conocida; es el único elemento conocido que presenta superfluidez; de la misma manera no puede ser solidificado por enfriamiento bajo condiciones estándar, sino que se convierte en sólido bajo una presión de 25 atm (2500 kPa; 370 psi) y 0,95 K (−272,20 °C; −457.960 °F).[28] Los gases nobles hasta el xenón tienen múltiples isótopos estables. El radón no tiene isótopos estables; su isótopo de mayor duración tiene un periodo de semidesintegración de 3,8 días que puede formar helio y polonio.[13]
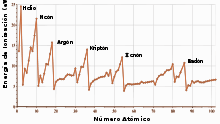
El radio atómico de los gases nobles aumenta de un periodo a otro debido al incremento en el número de electrones. El tamaño del átomo se relaciona con varias propiedades. Por ejemplo, el potencial de ionización disminuye a medida que aumenta el radio ya que los electrones de valencia en los átomos más grandes se encuentran más alejados del núcleo y, por lo tanto, no se encuentran ligados tan fuertemente por el átomo. Los gases nobles tienen los mayores potenciales de ionización de cada periodo, lo cual refleja lo estable que es su configuración electrónica y genera su falta de reactividad química.[29] Sin embargo, algunos de los gases nobles más pesados tienen potenciales de ionización lo suficientemente bajos para ser comparables a los de otros elementos y moléculas. El químico Neil Bartlett, intentando crear el compuesto de un gas noble, notó que el potencial de ionización del xenón era similar al de la molécula de oxígeno, por lo que intentó oxidar xenón usando hexafluoruro de platino, un agente oxidante tan fuerte que es capaz de reaccionar con oxígeno.[19] Los gases nobles no pueden aceptar un electrón para formar aniones estables. Esto quiere decir que poseen una afinidad electrónica negativa.[30]
Las propiedades físicas macroscópicas de los gases nobles están determinadas por las débiles fuerzas de Van der Waals que se dan entre átomos. Las fuerzas de atracción aumentan con el tamaño del átomo como un resultado del incremento en la polarizabilidad y el descenso del potencial de ionización. Esto lleva a tendencias grupales sistemáticas. Por ejemplo, a medida que se baja en los grupos de la tabla periódica, el radio atómico y las fuerzas interatómicas aumentan. De igual forma, se adquieren mayores puntos de fusión y de ebullición, entalpía de vaporización y solubilidad. El aumento de densidad se debe al incremento en masa atómica.[29]
Los gases nobles se comportan como gases ideales bajo condiciones normales de presión y temperatura, pero sus tendencias anormales a la ley de los gases ideales proporcionan claves importantes para el estudio de las fuerzas e interacciones moleculares. El potencial de Lennard-Jones, usado frecuentemente para modelar fuerzas intermoleculares, fue deducido en 1924 por John Lennard-Jones a partir de datos experimentales del argón antes de que el desarrollo de la mecánica cuántica proporcionara las herramientas necesarias para entender las fuerzas intermoleculares a partir de primeros principios.[31] El análisis teórico de estas fuerzas se volvió viable debido a que los gases nobles son monoatómicos, y por tanto isótropos (independientes de la dirección).
Propiedades químicas
| Z | Elemento | Electrones por capa |
|---|---|---|
| 2 | helio | 2 |
| 10 | neón | 2, 8 |
| 18 | argón | 2, 8, 8 |
| 36 | kriptón | 2, 8, 18, 8 |
| 54 | xenón | 2, 8, 18, 18, 8 |
| 86 | radón | 2, 8, 18, 32, 18, 8 |
En los seis primeros periodos de la tabla periódica, los gases nobles son exactamente los miembros del grupo 18 (8A) de la tabla (anteriormente conocido como grupo 0). Sin embargo, esto ya no es cierto en el séptimo periodo (debido a efectos relativistas): el siguiente miembro del grupo 18, el oganesson, probablemente no es tan gas noble.[32] En cambio, el miembro del grupo 14 Flerovio presenta propiedades similares a las de los gases nobles.[33]
Los gases nobles son incoloros, inodoros, insípidos y no inflamables en condiciones normales. Antiguamente se les asignaba el grupo 0 de la tabla periódica porque se creía que tenían una valencia cero, es decir, que sus átomos no se pueden combinar con otros elementos para formar compuestos. Sin embargo, más tarde se descubrió que algunos sí forman compuestos, haciendo que se abandonara esta denominación.[13] Se conoce muy poco sobre las propiedades del miembro más reciente del grupo 18, el oganesson (oganesson).[34] Los gases nobles tienen capas llenas de electrones de valencia. Los electrones de valencia son los electrones que se encuentran más al exterior de los átomos y normalmente son los únicos que participan en los enlaces químicos. Los átomos con capas de valencia llenas de electrones son extremadamente estables y por tanto no tienden a formar enlaces químicos y tienen poca tendencia a ganar o perder electrones.[35] Sin embargo, los gases nobles más pesados, como el radón, están unidos menos firmemente por la fuerza electromagnética que los más ligeros, como el helio, haciendo que sea más fácil retirar electrones exteriores de los gases nobles pesados. Debido a que dicha capa está completa, los gases nobles se pueden utilizar de acuerdo con la notación de configuración electrónica para dar lugar a una "notación de gases nobles". Para ello, primero se escribe el gas noble más cercano que precede al elemento en cuestión, y se continúa la configuración electrónica a partir de ese punto. Por ejemplo, la notación electrónica del carbono es 1s² 2s² 2p², y su notación de gas noble es [He] 2s² 2p². Esta notación hace que resulte más fácil identificar elementos, y es más corta que escribir toda la notación de orbitales atómicos.[36]
Compuestos
Los gases nobles tienen una reactividad extremadamente baja; a pesar de ello, se han formado una gran cantidad de compuestos de gases nobles. No se han formado compuestos neutros en los que el helio y el neón estén presentes en los enlaces químicos (aunque hay pruebas teóricas de algunos compuestos de helio), mientras que el xenón, el kriptón y el argón solo presentan una reactividad baja.[37] La reactividad sigue el orden Ne < He < Ar < Kr < Xe < Rn.
En 1933, Linus Pauling argumentó que los gases nobles más pesados podían formar compuestos con el flúor y el oxígeno. De igual forma, arguyó la existencia del hexafluoruro de kriptón (KrF6) y el hexafluoruro de xenón (XeF6), y especuló que el XeF8 podría existir como compuesto inestable, sugiriendo también que el ácido xénico (H2XeO4) podía formar sales de perxenato.[38][39] Se ha demostrado que estas predicciones eran generalmente precisas, salvo que actualmente se cree que el XeF8 es termodinámica y cinéticamente inestable.[40] Los compuestos de xenón son los más numerosos de los compuestos de gas noble que se han formado.[41] La mayoría de ellos tienen el átomo de xenón en el estado de oxidación +2, +4, +6 o +8 unido a átomos muy electronegativos como el flúor o el oxígeno, como en el fluoruro de xenón (XeF2), el tetrafluoruro de xenón (XeF4nmnvb), el hexafluoruro de xenón (XeF6), el tetraóxido de xenón (XeO4) y el perxenato de sodio (Na4XeO6). Algunos de estos compuestos han sido utilizados en la síntesis química como agentes oxidantes; el XeF2, en particular, está disponible comercialmente y se puede utilizar como agente fluorador.[42] En 2007, se habían identificado unos quinientos compuestos de xenón unidos a otros elementos, incluyendo compuestos organoxenones (unidos con carbono), así como xenón unido a nitrógeno, cloro, oro, mercurio y al propio xenón.[37] También se han observado compuestos de xenón unido a boro, hidrógeno, bromo, yodo, berilio, azufre, titanio, cobre y plata, pero solo a temperaturas bajas en matrices de gases nobles, o en jet streams de gases nobles.[37]
En teoría, el radón es más reactivo que el xenón, y por tanto debería formar enlaces químicos más fácilmente que el xenón. Sin embargo, debido a la gran radiactividad y la corta semivida de los isótopos del radón, en la práctica solo se han formado unos pocos fluoruros y óxidos de radón.[43] El kriptón es menos reactivo que el xenón, pero se han observado diversos compuestos con el kriptón en el estado de oxidación +2.[37] El difluoruro de kriptón es el más notable y fácil de caracterizar. También se han caracterizado compuestos en que el kriptón forma un enlace único con nitrógeno y oxígeno,[44] pero solo son estables por debajo de −60 °C y −90 °C, respectivamente. Se han observado átomos de kriptón unidos químicamente a otros no metales (hidrógeno, cloro, carbono), así como algunos metales de transición tardíos (cobre, plata, oro), pero solo o bien a temperaturas bajas.[37] Se utilizaron condiciones similares para obtener los primeros pocos compuestos de argón en el 2000, como el fluorohidruro de argón (HArF), y algunos unidos a los metales de transición tardíos.[37] En 2007 no se conocían moléculas neutras estables con átomos de helio o neón con enlaces covalentes.[37]
Los gases nobles, incluyendo el helio, pueden formar iones moleculares estables en fase gaseosa. El más simple es el hidrohelio, HeH+, descubierto en 1925.[45] Al estar compuesto por los dos elementos más abundantes del universo, el hidrógeno y el helio, se cree que se da naturalmente en el medio interestelar, aunque aún no ha sido detectado.[46] Además de estos iones, hay muchos excímeros neutros conocidos de estos gases. Hay compuestos como ArF y KrF que solo son estables cuando se encuentran en un estado electrónico excitado, y algunos de ellos se emplean en los láseres de excímeros.
Además de los compuestos en que un átomo de gas noble está implicado en un enlace covalente, los gases nobles también forman compuestos no covalentes. Los clatratos, descritos por primera vez en 1949,[47] consisten en un átomo de gas noble atrapado dentro de cavidades de la estructura cristalina de determinadas sustancias orgánicas e inorgánicas. La condición esencial para que se formen es que los átomos invitados (los del gas noble) deben tener el tamaño adecuado para encajar en las cavidades de la estructura cristalina del huésped. Por ejemplo, el argón, el kriptón y el xenón forman clatratos con la hidroquinona, pero el helio y el neón no, pues son demasiado pequeños o tienen una polarizabilidad insuficiente para ser retenidos.[48] El neón, el argón, el kriptón y el xenón también forman hidratos de clatratos; esto quiere decir que los gases nobles quedan atrapados dentro de la capa de helio de dichos compuestos.[49]
Los gases nobles pueden formar compuestos fulerenos endoédricos, en los que el átomo de gas noble está atrapado dentro de una molécula de fullereno. En 1993, se descubrió que cuando se expone C60, una molécula esférica compuesta de 60 átomos de carbono, gases nobles a una presión elevada, se pueden formar complejos como He@C60 (@ indica que He se encuentra contenido dentro de C60, pero que no está unido covalentemente).[50] En 2008 se obtuvieron complejos endohédricos con helio, neón, argón, kriptón y xenón.[51] Estos compuestos se utilizan en el estudio de la estructura y la reactividad de los fulerenos mediante la resonancia magnética nuclear del átomo de gas noble.[52]
Se considera que los compuestos de gases nobles, como el difluoruro de xenón (XeF2), son hipervalentes, pues violan la regla del octeto. Se puede explicar los enlaces en estos compuestos con un modelo de tres centros y cuatro electrones.[53][54] Este modelo, propuesto por primera vez en 1951, considera la unión de tres átomos colineales. Por ejemplo, los enlaces de XeF2 se describen por un conjunto de tres orbitales moleculares derivadas de los orbitales p de cada átomo. Los enlaces resultan de la combinación de un orbital p de Xe con un orbital p medio lleno de cada átomo de F, resultando en un orbital de enlace lleno, un orbital de enlace no lleno, y un orbital de antienlace. El orbital molecular ocupado más alto se encuentra en los dos átomos terminales. Esto representa una localización de la carga facilitada por la alta electronegatividad del flúor.[55] La química de los gases nobles más pesados, el kriptón y el xenón, está bien determinada. La de los más ligeros, el helio y el argón, aún se encuentra en un estado temprano, mientras que aún no se ha identificado algún compuesto de neón.
Abundancia y producción
La abundancia de los gases nobles en el universo disminuye a medida que aumenta su número atómico. El helio es el elemento más común en el universo después del hidrógeno, con una proporción de masa de aproximadamente el 24 %. La mayoría del helio del universo se formó durante la nucleosíntesis primordial, pero la cantidad de helio aumenta constantemente debido a la fusión de hidrógeno en la nucleosíntesis estelar (proceso realizado mediante reacciones nucleares que tiene su origen en las estrellas durante su proceso evolutivo, y que antecede a una supernova por colapso gravitatorio).[56][57] La abundancia en la Tierra muestra tendencias diferentes; por ejemplo, el helio es solo el tercer gas noble más abundante de la atmósfera. El motivo es que no hay helio primordial en la atmósfera, ya que debido a la pequeña masa de este átomo, el helio no puede ser retenido por el campo gravitatorio terrestre.[58] El helio de la Tierra deriva de la desintegración alfa de elementos pesados como el uranio o el torio de la corteza terrestre, y tiende a acumularse en yacimientos de gas natural.[58] Por otro lado, la abundancia del argón crece como resultado de la desintegración alfa del potasio-40, que también se encuentra en la corteza terrestre, para formar argón-40, que es el isótopo del argón más abundante de la Tierra a pesar de ser relativamente raro en el sistema solar. Este proceso es la base del método de datación por potasio-argón.[59] El xenón tiene una abundancia relativamente baja en la atmósfera, lo que se ha dado a conocer como el «problema del xenón desaparecido»; una teoría es que el xenón que falta podría estar atrapado en minerales dentro de la corteza terrestre.[60] El radón se forma en la litosfera por la desintegración alfa del radio. Se puede filtrar en edificios a través de los cimientos y acumularse en áreas mal ventiladas. Debido a su gran radiactividad, el radón supone un riesgo significativo para la salud; solo en Estados Unidos, está asociado con unas 21.000 muertes por cáncer de pulmón cada año.[61]
| Abundancia | Helio | Neón | Argón | Kriptón | Xenón | Radón |
|---|---|---|---|---|---|---|
| Sistema solar (por cada átomo de silicio)[62] | 2.343 | 2,148 | 0,1025 | 5,515 × 10−5 | 5,391 × 10−6 | – |
| Atmósfera terrestre (proporción en volumen en ppm)[63] | 5,20 | 18,20 | 9.340,00 | 1,10 | 0,09 | (0,06-18) × 10−19[64] |
| Roca ígnea (proporción en masa en ppm)[29] | 3 × 10−3 | 7 × 10−5 | 4 × 10−2 | – | – | 1,7 × 10−10 |
| Gas | Precio en el 2004 (USD/m³)[65] |
|---|---|
| Helio (grado industrial) | 4,20-4,90 |
| Helio (grado de laboratorio) | 22,30-44,90 |
| Argón | 2,70-8,50 |
| Neón | 60-120 |
| Kriptón | 400-500 |
| Xenón | 4000-5000 |
El neón, el argón, el kriptón y el xenón se obtienen a partir del aire utilizando los métodos de licuefacción de gases, para convertir los elementos a un estado líquido, y de destilación fraccionada, para separar las mezclas en sus componentes. El helio se produce generalmente separándolo del gas natural, y el radón se aísla de la desintegración radioactiva de los compuestos de radio.[13] El precio de los gases nobles está influido por su abundancia natural, siendo el argón el más barato y el xenón el más caro. Lo ilustra la tabla de la derecha, con los precios en USD de 2004 por cantidades de laboratorio de cada gas.
Usos
Los gases nobles tienen un punto de ebullición y de fusión muy bajos, lo que los hace útiles como refrigerantes criogénicos.[66] En particular, el helio líquido, que hierve a 4,2 K, se utiliza para imanes superconductores, como los que se emplean para la imagen por resonancia magnética y la resonancia magnética nuclear.[67] El neón líquido, aunque no llega a temperaturas tan bajas como el helio líquido, también tiene aplicaciones en la criogenia, pues tiene una capacidad de refrigeración más de 40 veces superior a la del helio líquido y más de tres veces superior a la del hidrógeno líquido.[64]
El helio se utiliza como componente de los gases respirables para sustituir al nitrógeno, gracias a su baja solubilidad en fluidos, especialmente en lípidos. Los gases son absorbidos por la sangre y los tejidos corporales cuando hay presión, como en el submarinismo, lo que provoca un efecto anestésico conocido como "mal de profundidad". Debido a su baja solubilidad, entra poco helio en las membranas celulares, y cuando se utiliza helio para sustituir parte de los gases respirables, como en el trimix o el heliox, se consigue una reducción del efecto narcótico del gas en profundidad. La baja solubilidad del helio ofrece más ventajas para el trastorno conocido como enfermedad por descompresión. A menor cantidad de gas disuelto en el cuerpo significa que se forman menos burbujas de gas durante la reducción de la presión durante el ascenso. Otro gas noble, el argón, es considerado la mejor opción como gas de inflación del traje seco en el submarinismo.
Desde el desastre del Hindenburg de 1937,[68] el helio ha sustituido al hidrógeno como gas de sustentación en los dirigibles y globos,[68] gracias a su ligereza e incombustibilidad, pese a una reducción en la flotabilidad de un 8,6 %. En muchas aplicaciones, los gases nobles se utilizan para formar una atmósfera inerte. El argón se utiliza en la síntesis de compuestos sensibles al aire que al mismo tiempo, son sensibles al nitrógeno. El argón sólido también se utiliza para estudiar compuestos muy inestables, como intermedios reactivos, atrapándolos en una matriz inerte a temperaturas muy bajas.[69] El helio es utilizado como medio portador en la cromatografía de gases, como gas de relleno en los termómetros, y en aparatos para medir la radiación, como el contador Geiger y la cámara de burbujas. Tanto el helio como el argón se utilizan habitualmente para proteger arcos de soldadura y el metal base circundante de la atmósfera durante la soldadura y la ablación, así como en otros procesos metalúrgicos y la producción de silicio para la industria de los semiconductores.[64]
Los gases nobles se usan habitualmente para la iluminación debido a su falta de reactividad química. El argón, mezclado con nitrógeno, se utiliza como gas de relleno de las bombillas incandescentes.[64] El kriptón se usa en bombillas de alto rendimiento, que tienen una temperatura de color más elevada y una mayor eficacia, pues reduce la velocidad de evaporación del filamento más que el argón, las lámparas de halógeno, en particular, utilizan kriptón mezclado con pequeñas cantidades de compuestos de yodo o bromo.[64] Los gases nobles lucen con colores característicos cuando se les utiliza en lámparas de descarga, como los faros de neón, que producen un color naranja-rojo. El xenón es utilizado habitualmente en faros de xenón que, debido a su espectro casi continuo que se asemeja a la luz del día, se usan en proyectores de películas y como faros de automóvil.[64]
Los gases nobles se usan en láseres de excímeros, que se basan en moléculas excitadas electrónicamente de vida corta conocidas como excímeros. Los excímeros utilizados en los láseres pueden ser dímeros de gases nobles como Ar 2, Kr 2 o Xe 2, o más habitualmente, el gas noble es combinado con un halógeno en excímeros como ArF, KrF, XeF o XeCl. Estos láseres producen una luz ultravioleta que, debido a su longitud de onda corta (193 nm por ArF y 248 nm para KrF), permite una imagen de alta precisión. Los láseres de excímeros tienen muchos usos industriales, médicos y científicos. Se utilizan en la microlitografía y la microfabricación, esenciales para la manufactura de circuitos integrados y por cirugía láser, incluyendo la angioplastia láser y la cirugía ocular.[70] Algunos gases nobles tienen un uso directo en la medicina. A veces se usa el helio para mejorar la facilidad de respiración de los pacientes con asma.[64] El xenón se utiliza como anestésico debido a su alta solubilidad en lípidos, que lo hace más potente que el habitual óxido nitroso, y como es eliminado fácilmente por el cuerpo, permite un restablecimiento más rápido.[71] La captación de imágenes hechas a través de la resonancia magnética nuclear utiliza el xenón en combinación con otros gases. El radón, que es muy radiactivo y solo está disponible en cantidad mínimas, sirve en el tratamiento por radioterapia.
Color de descarga
- Colores producidos por los diferentes gases nobles en tubos de neón




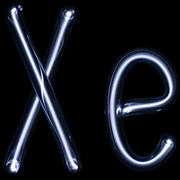

El color de la emisión de descarga del gas depende de varios factores, incluyendo los siguientes:[72]
- parámetros de descarga (valor local de la densidad de corriente y campo eléctrico, temperatura, etc;
- pureza del gas (incluso una pequeña fracción de ciertos gases puede afectar el color);
- material de la envoltura del tubo de descarga.
Véase también
- Compuesto de gas noble
- Inercia química
- Gas inerte
- Tabla periódica de los elementos
Fuentes
Notas y referencias
- Atkins, Peter; Jones, Loretta (2006). Principios de química: los caminos del descubrimiento. Ed. Médica Panamericana. ISBN 9789500600804. Consultado el 2 de marzo de 2018.
- Melo, Sergio Hurtado (30 de septiembre de 2014). Operaciones básicas del proceso, mezclas y disoluciones. QUIE0108. IC Editorial. ISBN 9788416207046. Consultado el 2 de marzo de 2018.
- Pérez, Rogelio González (22 de agosto de 2013). Criogenia: Cálculo de equipos. Recipientes a presión. Ediciones Díaz de Santos. ISBN 9788499698755. Consultado el 2 de marzo de 2018.
- Sharpe, Alan G. (September 1996). Química inorgánica. Reverte. ISBN 9788429175011. Consultado el 2 de marzo de 2018.
- Renouf, Edward (15 de febrero de 1901). «Noble gases». Science 13: 268-270. doi:10.1126/science.13.320.268.
- Ozima, 2002, p. 30
- Ozima, 2002, p. 4
- «argon». Encyclopædia Britannica. 2008.
- Oxford English Dictionary (1989), s.v. "helium". Retrieved December 16, 2006, from Oxford English Dictionary Online. También, citado allí: Thomson, W. (1872). Rep. Brit. Assoc. xcix: "Frankland y Lockyer encuentran que las prominencias amarillas emiten una línea brillante muy marcada no muy lejos de D, pero que hasta ahora no se ha identificado con ninguna llama terrestre. Parece indicar una nueva sustancia, que proponen llamar helio."
- Ozima 2002, p. 1
- Mendeleev, 1903, p. 497
- Partington, J. R. (May de 1957). «Discovery of Radon». Nature 179 (4566): 912. doi:10.1038/179912a0.
- «Noble Gas». Encyclopædia Britannica. 2008.
- Cederblom, J. E. (1904). «The Nobel Prize in Physics 1904 Presentation Speech».
- Cederblom, J. E. (1904). «The Nobel Prize in Chemistry 1904 Presentation Speech».
- Ramsay, pp. 258.
- Moissan, pp. 185.
- Gillespie, R. J.; Robinson, E. A. (January de 2007). «Gilbert N. Lewis and the chemical bond: the electron pair and the octet rule from 1916 to the present day». J Comput Chem 28 (1): 87-97. PMID 17109437. doi:10.1002/jcc.20545.
- Bartlett, N. (1962). «Xenon hexafluoroplatinate Xe+[PtF6]-». Proceedings of the Chemical Society (6): 218. doi:10.1039/PS9620000197.
- Fields, Paul R.; Stein, Lawrence; Zirin, Moshe H. (1962). «Radon Fluoride». Journal of the American Chemical Society 84 (21): 4164-4165. doi:10.1021/ja00880a048.
- Grosse, A. V.; Kirschenbaum, A. D.; Streng, A. G.; Streng, L. V. (1963). «Krypton Tetrafluoride: Preparation and Some Properties». Science 139: 1047-1048. PMID 17812982. doi:10.1126/science.139.3559.1047.
- Khriachtchev, Leonid; Pettersson, Mika; Runeberg, Nino; Lundell, Jan; Räsänen, Markku (24 de agosto de 2000). «A stable argon compound». Nature 406 (406): 874-876. doi:10.1038/35022551.
- Oganessian, Yu. Ts. (1999). «Synthesis of Superheavy Nuclei in the 48Ca + 244Pu Reaction». Physical Review Letters (American Physical Society) 83: 3154. doi:10.1103/PhysRevLett.83.3154.
- Woods, Michael (6 de mayo de 2003). «Chemical element No. 110 finally gets a name—darmstadtium». Pittsburgh Post-Gazette. Consultado el 26 de junio de 2008.
- «Gas Phase Chemistry of Superheavy Elements» (PDF). Texas A&M University. Archivado desde el original el 28 de mayo de 2008. Consultado el 31 de mayo de 2008.
- Barber, Robert C.; Paul J. Karol, Hiromichi Nakahara, Emanuele Vardaci y Erich W. Vogt (2011). «Discovery of the elements with atomic numbers greater than or equal to 113 (IUPAC Technical Report)*». Pure Appl. Chem. 83 (7).
- Oganessian, Yu. Ts. (9 de octubre de 2006). «Synthesis of the isotopes of elements 118 and 116 in the Californium 249, and Curium, 245 and Calcium 48 fusion reactions». Physical Review C 74 (4): 44602. doi:10.1103/PhysRevC.74.044602.
- «Solid Helium». University of Alberta. Archivado desde el original el 31 de mayo de 2008. Consultado el 22 de junio de 2008.
- Greenwood, 1997, p. 891
- Wheeler, John C. (1997). «Electron Affinities of the Alkaline Earth Metals and the Sign Convention for Electron Affinity». Journal of Chemical Education 74: 123-127.; Kalcher, Josef; Sax, Alexander F. (1994). «Gas Phase Stabilities of Small Anions: Theory and Experiment in Cooperation». Chemical Reviews 94: 2291-2318. doi:10.1021/cr00032a004.
- Mott, N. F. (1955). «John Edward Lennard-Jones. 1894-1954». Biographical Memoirs of Fellows of the Royal Society 1: 175-184. doi:10.1098/rsbm.1955.0013.
- Clinton S. Nash. «Atomic and Molecular Properties of Elements 112, 114, and 118». J. Phys. Chem. A, vol. 109, 15, pp. 3493-3500 (en inglés). Consultado el 7 de enero de 2010.
- Conferencia de Heinz W. Gäggeler. «Gas Phase Chemistry of Superheavy Elements» (en inglés). Archivado desde el original el 20 de febrero de 2012. Consultado el 7 de enero de 2010.
- «Scientists Announce Creation of Atomic Element, the Heaviest Yet». Washington Post. Consultado el 7 de enero de 2010.
- Ozima 2002, p. 35
- CliffsNotes 2007, p. 15.
- Grochala, Wojciech (2007). "Atypical compounds of gases, which have been called noble". Chemical Society Reviews 36 (36): 1632-1655. doi:10.1039/b702109g
- Pauling, Linus (1933). "The Formulas of Antimonic Acid and the Antimonates". Journal of the American Chemical Society 55 (5): 1895-1900. doi:10.1021/ja01332a016
- Holloway 1968
- Seppelt, Konrad (1979). "Recent developments in the Chemistry of Some Electronegative Elements". Accounts of Chemical Research 12: 211–216. doi:10.1021/ar50138a004
- Moody G. J. «A Decade of Xenon Chemistry». Journal of Chemical Education, vol. 51, 10, pp. 628-630 (en inglés). Consultado el 7 de enero de 2010.
- Zupan, Marko; Iskra, Jernej; Stavber, Stojan. «Fluorination with XeF2. 44. Effect of Geometry and Heteroatom on the Regioselectivity of Fluorine Introduction into an Aromatic Ring». J. Org. Chem, vol. 63, 3, pp. 878-880.
- Avrorin, V. V.; Krasikova, R. N.; Nefedov, V. D.; Toropova, M. A. «The Chemistry of Radon». Russian Chemical Review, vol. 51, 1, pp. 12-20.
- Moody, G. J. «10.1016/S0010-8545(02)00202-3» (en inglés). Consultado el 7 de enero de 2010.
- Hogness, T. R.; Lunn, E. G.. «The Ionization of Hydrogen by Electron Impact as Interpreted by Positive Ray Analysis». Physical Review, vol. 26, pp. 44-55.
- Fernandez, J.; Martin, F.. «Photoionization of the HeH2+ molecular ion». J. Phys. B: At. Mol. Opt. Phys, vol. 40, pp. 2471-2480.
- Powell, H. M. y M. Guter. «An Inert Gas Compound». Nature, vol. 164, pp. 240-241.
- Greenwood 1997, p. 893.
- Dyadin, Yuri A.; Eduard G. Larionov, Andrei Yu. Manakov, Fridrich V. Zhurko, Evgeny Ya. Aladko, Tamara V. Mikina, Vladislav Yu. Komarov. «Clathrate hydrates of hydrogen and neon». Mendeleev Communications, vol. 9, 5, pp. 209-210.
- Saunders, M.; Jiménez-Vázquez, H. A.; Cross, R. J.; Poreda, R. J.. «Stable compounds of helium and neon. He@C60 and Ne@C60». Science, vol. 259, pp. 1428-1430.
- Saunders, Martin; Jimenez-Vazquez, Hugo A.; Cross, R. James; Mroczkowski, Stanley; Gross, Michael L.; Giblin, Daryl E.; Poreda, Robert J. «Incorporation of helium, neon, argon, krypton, and xenon into fullerenes using high pressure». J. Am. Chem. Soc., vol. 116, 5, pp. 2193-2194.
- Frunzi, Michael; Cross, R. James; Saunders, Martin. «Effect of Xenon on Fullerene Reactions». Journal of the American Chemical Society, vol. 129, pág. 13343.
- Greenwood 1997, p. 897.
- Weinhold 2005, pp. 275-306.
- Pimentel, G. C. «The Bonding of Trihalide and Bifluoride Ions by the Molecular Orbital Method». The Journal of Chemical Physics, vol. 19, 4, pp. 446-448.
- Weiss, Achim. «Elements of the past: Big Bang Nucleosynthesis and observation». Max Planck Institute for Gravitational Physics. Archivado desde el original el 8 de febrero de 2007. Consultado el 23 de junio de 2008.
- Coc, A. et al. (2004). «Updated Big Bang Nucleosynthesis confronted to WMAP observations and to the Abundance of Light Elements». Astrophysical Journal 600: 544. doi:10.1086/380121.
- Morrison, P.; Pine, J. (1955). «Radiogenic Origin of the Helium Isotopes in Rock». Annals of the New York Academy of Sciences 62 (3): 71-92. doi:10.1111/j.1749-6632.1955.tb35366.x.
- Scherer, Alexandra (16 de enero de 2007). «40Ar/39Ar dating and errors». Technische Universität Bergakademie Freiberg. Archivado desde el original el 14 de octubre de 2007. Consultado el 26 de junio de 2008.
- Sanloup, Chrystèle; et al. (2005). «Retention of Xenon in Quartz and Earth's Missing Xenon». Science 310 (5751): 1174-1177. PMID 16293758. doi:10.1126/science.1119070.
- «A Citizen's Guide to Radon». U.S. Environmental Protection Agency. 26 de noviembre de 2007. Consultado el 26 de junio de 2008.
- Lodders, Katharina (2003). «Solar System Abundances and Condensation Temperatures of the Elements». The Astrophysical Journal 591: 1220-1247. doi:10.1086/375492.
- «The Atmosphere». National Weather Service. Consultado el 1 de junio de 2008.
- Häussinger, Peter; Glatthaar, Reinhard; Rhode, Wilhelm; Kick, Helmut; Benkmann, Christian; Weber, Josef; Wunschel, Hans-Jörg; Stenke, Viktor; Leicht, Edith; Stenger, Hermann. «Noble gases», Ullmann's Encyclopedia of Industrial Chemistry. Wiley, 2002. DOI:10.1002/14356007.a17_485
- Hwang, Shuen-Chen; Lein, Robert D.; Morgan, Daniel A. (2005). «Noble Gases». Kirk Othmer Encyclopedia of Chemical Technology. Wiley. pp. 343-383. doi:10.1002/0471238961.0701190508230114.a01.
- "Neón". Encarta. (2008).
- Zhang, C. J.; Zhou, X. T.; Yang, L. «Demountable coaxial gas-cooled current leads for MRI superconducting magnets». Magnetics, IEEE Transactions, vol. 28, 1, pp. 957-959.
- "Disaster Ascribed to Gas by Experts", The New York Times (07-05-1937), p. 1.
- Dunkin, I. R. «The matrix isolation technique and its application to organic chemistry». Chem. Soc. Rev., vol. 9, pp. 1-23.
- Basting, Dirk; Marowsky, Gerd. Excimer Laser Technology. Springer, 2005. ISBN 3-540-20056-8.
- Sanders, Robert D.; Ma, Daqing; Maze, Mervyn. «Xenon: elemental anaesthesia in clinical practice». British Medical Bulletin, vol. 71, 1, pp. 115-135. Consultado el 2 de octubre de 2007.
- Ray, Sidney F. (1999). Scientific photography and applied imaging (en inglés). Focal Press. pp. 383-384. ISBN 0-240-51323-1.
Bibliografía
- Bennett, Peter B.; Elliott, David H. (1998). The Physiology and Medicine of Diving. SPCK Publishing. ISBN 0702024104.
- Bobrow Test Preparation Services (5 de diciembre de 2007). CliffsAP Chemistry. CliffsNotes. ISBN 047013500X.
- Greenwood, N. N.; Earnshaw, A. (1997). Chemistry of the Elements (2da edición). Oxford: Butterworth-Heinemann. ISBN 0-7506-3365-4.
- Harding, Charlie J.; Janes, Rob (2002). Elements of the P Block. Royal Society of Chemistry. ISBN 0854046909.
- Holloway, John H. (1968). Noble-Gas Chemistry. Londres: Methuen Publishing. ISBN 0412211009.
- Mendeléyev, D. (1902-1903). Osnovy Khimii (The Principles of Chemistry) (en ruso) (7ma edición).
- Ozima, Minoru; Podosek, Frank A. (2002). Noble Gas Geochemistry. Cambridge University Press. ISBN 0521803667.
- Weinhold, F.; Landis, C. (2005). Valency and bonding. Cambridge University Press. ISBN 0521831288.