Nitrógeno
El nitrógeno es un elemento químico de número atómico 7, símbolo N, su masa atómica es de 14,0067 y que en condiciones normales forma un gas diatómico (nitrógeno diatómico o molecular) que constituye del orden del 78 % del aire atmosférico.[1] En ocasiones es llamado ázoe (antiguamente se usó también Az como símbolo del nitrógeno).
| Carbono ← Nitrógeno → Oxígeno | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tabla completa • Tabla ampliada | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Incoloro | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Información general | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | Nitrógeno, N, 7 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie química | No metales | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 15, 2, p | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atómica | 14,007 u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [He]2s22p3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrones por nivel | 2, 5 (imagen) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio medio | 65 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividad | 3,04 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio atómico (calc) | 56 pm (radio de Bohr) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 75 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio de van der Waals | 155 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado(s) de oxidación | ±3, 5, 4, 2, 1 (ácido fuerte) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1.ª energía de ionización | 1402,3 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2.ª energía de ionización | 2856 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3.ª energía de ionización | 4578,1 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4.ª energía de ionización | 7475 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5.ª energía de ionización | 9444,9 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6.ª energía de ionización | 53266,6 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 7.ª energía de ionización | 64360 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado ordinario | Gas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad | 1,2506 kg/m3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusión | 63,14 K (−210 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullición | 77,35 K (−196 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de vaporización | 5,57 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de fusión | 0,7087 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto crítico |
126,19 K (−147 °C) 3.39 MPa Pa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Varios | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | hexagonal | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor específico | 1040 J/(K·kg) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad eléctrica | __ 106 S/m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 0,02598 W/(K·m) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidad del sonido | 334 m/s a 293,15 K (20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isótopos más estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Isótopos del nitrógeno | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Valores en el SI y condiciones normales de presión y temperatura, salvo que se indique lo contrario. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Aplicación
La aplicación comercial más importante del nitrógeno diatómico es la obtención de amoníaco por el proceso de Haber. El amoníaco se emplea con posterioridad en la fabricación de fertilizantes y ácido nítrico.
Las sales del ácido nítrico incluyen importantes compuestos como el nitrato de potasio (nitro o salitre empleado en la fabricación de pólvora) y el nitrato de amonio fertilizante.
Los compuestos orgánicos de nitrógeno como la nitroglicerina y el trinitrotolueno son a menudo explosivos. La hidracina y sus derivados se usan como combustible en cohetes.
El ciclo de este elemento es bastante más complejo que el del carbono, dado que está presente en la atmósfera no solo como N2 (78 %) sino también en una gran diversidad de compuestos. Se puede encontrar principalmente como N2O, NO y NO2, los llamados NOx. También forma otras combinaciones con oxígeno tales como N2O3 y N2O5 (anhídridos), "precursores" de los ácidos nitroso y nítrico. Con hidrógeno forma amoníaco (NH3), compuesto gaseoso en condiciones normales.
Al ser un gas poco reactivo, el nitrógeno se emplea industrialmente para crear atmósferas protectoras y como gas criogénico para obtener temperaturas del orden de 78 K de forma sencilla y económica. Inclusive se utiliza para inflar los neumáticos en los trenes de aterrizaje de los aviones, evitando condensación de agua a grandes alturas o su combustión al aterrizar.[2]
Etimología
Se considera que el nitrógeno (del latín nitrum -i, a su vez del griego νίτρον, "nitro" -nombre que históricamente se ha usado en forma vaga para referirse a diversos compuestos de sodio y de potasio que contienen nitrógeno-, y -geno, de la raíz griega γεν-, "generar"; es decir, "que genera salitre"[3]) fue descubierto formalmente por Daniel Rutherford en 1772, al dar a conocer algunas de sus propiedades (lo llamó "aire flogisticado", en función de lo que observó en su experimento de ese año[4]). Sin embargo, por la misma época también se dedicaron a su estudio Carl Wilhelm Scheele, quien lo aisló, Henry Cavendish y Joseph Priestley.
El nitrógeno es un gas tan inerte que Antoine Lavoisier se refería a él con el nombre azote (del griego ázoe, que significa "sin vida"[5][6] (o tal vez lo llamó así por no ser apto para respirar[7]). Se clasificó entre los gases permanentes, sobre todo desde que Michael Faraday no consiguió verlo líquido a 50 atmósferas (atm) y –110 °C hasta los experimentos de Raoul Pictet y Louis Paul Cailletet, quienes en 1877 consiguieron licuarlo.
Los compuestos de nitrógeno ya se conocían en la Edad Media; así, los alquimistas llamaban aqua fortis al ácido nítrico y aqua regia (agua regia) a la mezcla de ácido nítrico y ácido clorhídrico, mezcla conocida por su capacidad para disolver el oro y el platino.
Abundancia y obtención
El nitrógeno es el componente principal de la atmósfera terrestre (78,1 % en volumen) y se obtiene para usos industriales de la destilación del aire líquido. Está presente también en los restos de animales, por ejemplo el guano, usualmente en la forma de urea, ácido úrico y compuestos de ambos. Por deficiencia causa falta de relajación de los músculos, problemas en el sistema cardiovascular, en el nervioso central y periférico.
También ocupa el 3 % de la composición elemental del cuerpo humano.
Se han observado compuestos que contienen nitrógeno en el espacio exterior y el isótopo Nitrógeno-14 se crea en los procesos de fusión nuclear de las estrellas.
La mayor parte del nitrógeno utilizado en la industria química se obtiene por destilación fraccionada del aire líquido, y se usa para sintetizar amoníaco. A partir de este amoníaco se preparan una gran variedad de productos químicos.
Compuestos
Con el hidrógeno forma el amoníaco (NH3), los nitritos (NO2), los nitratos (NO3), los ácidos nítricos (HNO3), la hidracina (N2H4) y el aziduro de hidrógeno (N3H, también conocido como azida de hidrógeno o ácido hidrazoico). El amoníaco líquido, anfótero como el agua, actúa como una base en una disolución acuosa, formando iones amonio (NH4+), y se comporta como un ácido en ausencia de agua, cediendo un protón a una base y dando lugar al anión amida (NH2). Se conocen largas cadenas y compuestos cíclicos de nitrógeno, pero son muy inestables.
Con los halógenos forma: NF3, NF2Cl, NFCl2, NCl3, NBr3.6 NH3, NI3.6 NH3, N2F4, N2F2 (cis y trans), N3F, N3Cl, N3Br y N3I.
Con el oxígeno forma varios óxidos que ya hemos nombrado: el nitroso o gas de la risa, el nítrico y el dióxido de nitrógeno. Son producto de procesos de combustión contribuyendo a la aparición de episodios contaminantes de smog fotoquímico. Otros óxidos son el trióxido de dinitrógeno (N2O3) y el pentóxido de dinitrógeno (N2O5), ambos muy inestables y explosivos.
Importancia biológica
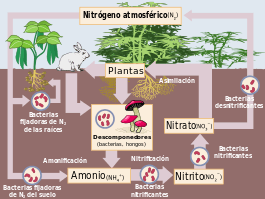
El nitrógeno es un componente esencial de los aminoácidos y los ácidos nucleicos vitales para los seres vivos. De todos los nutrientes minerales, es el que mayor efecto tiene en el crecimiento de las plantas y, por lo tanto, en la productividad primaria de los ecosistemas, lo que afecta a su vez a todos los organismos que dependen de ellas:[8] El aumento en el rendimiento de las cosechas a partir de que se comenzaron a utilizar fertilizantes nitrogenados en el siglo XIX lo demuestra.[9] A pesar de la gran cantidad de nitrógeno atmosférico, este elemento es limitante: pocos organismos pueden asimilarlo en esta forma. Las plantas solamente pueden asimilarlo eficientemente forma de iones amonio (NH4+) o nitrato (NO3-), aunque también pueden absorber pequeñas cantidades de aminoácidos y urea.[10]
Algunas plantas han establecido relaciones simbióticas con hongos y procationtes capaces de reducir el nitrógeno atmosférico a amonio, a cambio de lo cual reciben moléculas energéticas de la planta hospedera. El nitrógeno reducido es así incorporado a la cadena trófica (véase también el ciclo del nitrógeno). Quizás el caso más conocido sea el de las bacterias del género Rhizobium con las leguminosas, pero también existen asociaciones con bacterias del género Frankia e inclusive algunas cianobacterias. Finalmente, también algunos hongos, llamados ectomicorrízicos, extienden sus filamentos más allá del alcance de las raíces, formando micorrizas que hacen más eficiente la absorción de nitritos, nitratos y amonio del suelo en ambientes limitantes.[11]
Isótopos
Existen dos isótopos estables del nitrógeno, 14N y 15N, siendo el primero —que se produce en el ciclo carbono-nitrógeno de las estrellas— el más común sin lugar a dudas (99,634 %). Se ha logrado sintetizar diez isótopos de nitrógeno de los cuales, el 13N tiene un periodo de semidesintegración de nueve minutos. En el resto de isótopos, el periodo de semidesintegración es menor a 10 segundos, e incluso algún isótopo tiene un periodo de semidesintegración mucho menor al segundo.
Las reacciones biológicas de nitrificación y desnitrificación influyen de manera determinante en la dinámica del nitrógeno en el suelo, casi siempre produciendo un enriquecimiento en N-15 del sustrato.
Precauciones
Los fertilizantes nitrogenados son una importante fuente de contaminación del suelo y de las aguas. Los compuestos que contienen iones de cianuro forman sales extremadamente tóxicas y son mortales para numerosos animales, entre ellos los mamíferos.
Efectos del nitrógeno sobre la salud
Las moléculas de nitrógeno, en estado natural, se encuentran principalmente en el aire. En el agua y en los suelos el nitrógeno puede ser encontrado compuesto, en forma de nitratos y nitritos.
Los humanos han cambiado radicalmente las proporciones naturales de nitratos y nitritos, mayormente debido a la aplicación de estiércoles que contienen nitrato. El nitrógeno es emitido en grandes cantidades por las industrias. A lo largo de la historia, se nota un incremento de la presencia de nitratos y nitritos en el suelo y en el agua como consecuencia de reacciones que tienen lugar en el ciclo del nitrógeno. Esto se refleja en un incremento de la concentración de nitrógeno en las fuentes utilizadas para consumo humano, y por ende también en el agua potable.
Los nitratos y nitritos son conocidos por causar varios efectos sobre la salud humana. Estos son los efectos más comunes:[12]
- Tiene reacciones con la hemoglobina en la sangre, causando una disminución en la capacidad de transporte de oxígeno por la sangre. (nitrito)
- Provoca la disminución del funcionamiento de la glándula tiroidea. (nitrato)
- Ocasiona un bajo almacenamiento de la vitamina A. (nitrato)
- Favorece la producción de nitrosaminas, las cuales son conocidas como una de las causas más comunes de cáncer. (nitratos y nitritos)
Desde un punto de vista metabólico, el óxido de nitrógeno (NO) es mucho más importante que el nitrógeno. En 1987, Salvador Moncada descubrió que este era un mensajero vital del cuerpo para la relajación de los músculos, y hoy se sabe que está involucrado en el sistema cardiovascular, el sistema inmunitario, el sistema nervioso central y el sistema nervioso periférico. La enzima que produce el óxido nítrico, la óxido-nítrico sintasa, es abundante en el cerebro.[13]
Aunque el óxido nítrico tiene una vida relativamente corta, se puede difundir a través de las membranas para llevar a cabo sus funciones. En 1991, un equipo encabezado por K. E. Anderson del hospital universitario de Lund, Suecia, demostró que el óxido nítrico activa la erección por medio de la relajación del músculo que controla el flujo de sangre en el pene. La droga Viagra trabaja liberando óxido nítrico para producir el mismo efecto.[14]
Véase también
- Ciclo del nitrógeno
- Dinitrógeno
- Nitrógeno líquido
- Hidroxilamina
Referencias
- NASA Earth Fact Sheet, (actualizado al 17 de noviembre de 2010). Consultado el 26 de febrero de 2013.
- Brian Chelius (2005). «Airplane Wheel and Tire Servicing». www.boeing.com. Consultado el 14 de diciembre de 2016.
- Asimov, Isaac (2014). Breve historia de la química: Introducción a las ideas y conceptos de la química. Alianza Editorial (El Libro de Bolsillo). p. 81. ISBN 978-84-206-6421-7.
- Asimov, Isaac (2014). Breve historia de la química: Introducción a las ideas y conceptos de la química. Alianza Editorial (El Libro de Bolsillo). pp. 69-70. ISBN 978-84-206-6421-7.
- Asimov, Isaac (1999). Momentos estelares de la ciencia. Alianza. 842063980X.
- Asimov, Isaac (2014). Breve historia de la química: Introducción a las ideas y conceptos de la química. Alianza Editorial (El Libro de Bolsillo). p. 83. ISBN 978-84-206-6421-7.
- Salvat, Juan (1970). Diccionario enciclopédico Salvat universal. Salvat. 8434532212.
- Campbell, Neil A.; Reece, Jane B. (1 de enero de 2007). Biología. Ed. Médica Panamericana. ISBN 9788479039981. Consultado el 14 de diciembre de 2016.
- Chaillou, Sylvain; Lamaze, Thierry (2001). «Ammoniacal Nutrition of Plants». En Jean-Francois Morot-Gaudry, ed. Nitrogen assimilation by plants: physiological, biochemical and molecular aspects. Science Publishers. ISBN 1-57808-139-4. OCLC 44702175.
- Grignon, Claude; Thibaud, Jean-Baptiste; Lamaze, Thierry (2001). «Transport of Nitrate by Roots». En Jean-Francois Morot-Gaudry,, ed. Nitrogen assimilation by plants : physiological, biochemical and molecular aspects. Science Publishers. ISBN 1-57808-139-4. OCLC 44702175.
- Jean-Francois, Morot-Gaudry (2001). Nitrogen assimilation by plants : physiological, biochemical and molecular aspects. Science Publishers. OCLC 44702175.
- Mayor información sobre los efectos en la salud humana.
- «El sistema nervioso central humano». p. 431.
- «Fisiología Humana». p. 198.
Enlaces externos
 Wikimedia Commons alberga una galería multimedia sobre Nitrógeno.
Wikimedia Commons alberga una galería multimedia sobre Nitrógeno.- Enciclopedia Libre.
- WebElements.com – Nitrógeno.
- EnvironmentalChemistry.com – Nitrógeno.
- It's Elemental – Nitrógeno.
- Schenectady County Community College – Nitrógeno.
- Instituto Nacional de Seguridad e Higiene en el Trabajo de España: Ficha internacional de seguridad química del nitrógeno licuado.
- Termoquímica, Configuración Electrónica y la Vinculación, Isótopos, y Reacciones.