Cobre
El cobre (del latín cuprum, y este del griego kypros, Chipre),[5] cuyo símbolo es Cu, es el elemento químico de número atómico 29. Se trata de un metal de transición de color cobrizo, es decir, rojizo anaranjado de brillo metálico que, junto con la plata, el oro y el roentgenio forma parte de la llamada familia del cobre, se caracteriza por ser uno de los mejores conductores de electricidad (el segundo después de la plata). Gracias a su alta conductividad eléctrica, ductilidad y maleabilidad, se ha convertido en el material más utilizado para fabricar cables eléctricos y otros elementos eléctricos y componentes electrónicos.
| Níquel ← Cobre → Zinc | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tabla completa • Tabla ampliada | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Metálico, cobrizo  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Información general | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | Cobre, Cu, 29 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie química | Metales de transición | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 11, 4, d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atómica | 63,546 u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [Ar]3d104s1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza Mohs | 3,0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrones por nivel | 2, 8, 18, 1 (imagen) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio medio | 135[1] pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividad | 1,9 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio atómico (calc) | 145[1] pm (radio de Bohr) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 138[1] pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio de van der Waals | 140[1] pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado(s) de oxidación | +1, +2, +3, +4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Óxido | Levemente básico | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1.ª energía de ionización | 745,5 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2.ª energía de ionización | 1957,9 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3.ª energía de ionización | 3555 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4.ª energía de ionización | 5536 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado ordinario | Sólido (diamagnético) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad | 8960[2] kg/m3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusión | 1357,77 K (1085 °C) [3] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullición | 2835 K (2562 °C) [3] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de vaporización | 300[4] kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de fusión | 13,1[4] kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Varios | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | Cúbica centrada en las caras | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor específico | 385 J/(K·kg) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad eléctrica | 58,108 × 106 S/m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 400 W/(K·m) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidad del sonido | 3570 m/s a 293,15 K (20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isótopos más estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Isótopos del cobre | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Valores en el SI y condiciones normales de presión y temperatura, salvo que se indique lo contrario. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El cobre forma parte de una cantidad muy elevada de aleaciones que generalmente presentan mejores propiedades mecánicas, aunque tienen una conductividad eléctrica menor. Las más importantes son conocidas con el nombre de bronces y latones. Por otra parte, el cobre es un metal duradero porque se puede reciclar un número casi ilimitado de veces sin que pierda sus propiedades mecánicas.
Fue uno de los primeros metales en ser utilizado por el ser humano en la prehistoria. El cobre y su aleación con el estaño, el bronce, adquirieron tanta importancia que los historiadores han llamado Edad del cobre y Edad del Bronce a dos periodos de la Antigüedad. Aunque su uso perdió importancia relativa con el desarrollo de la siderurgia, el cobre y sus aleaciones siguieron siendo empleados para hacer objetos tan diversos como monedas, campanas y cañones. A partir del siglo XIX, concretamente de la invención del generador eléctrico en 1831 por Faraday, el cobre se convirtió de nuevo en un metal estratégico, al ser la materia prima principal de cables e instalaciones eléctricas.
El cobre posee un importante papel biológico en el proceso de fotosíntesis de las plantas, aunque no forma parte de la composición de la clorofila. El cobre contribuye a la formación de glóbulos rojos y al mantenimiento de los vasos sanguíneos, nervios, sistema inmunitario y huesos y por tanto es un oligoelemento esencial para la vida humana.[6]
El cobre se encuentra en una gran cantidad de alimentos habituales de la dieta tales como ostras, mariscos, legumbres, vísceras y nueces entre otros, además del agua potable y por lo tanto es muy raro que se produzca una deficiencia de cobre en el organismo. El desequilibrio de cobre ocasiona en el organismo una enfermedad hepática conocida como enfermedad de Wilson.[7]
El cobre es el tercer metal más utilizado en el mundo, por detrás del hierro y el aluminio. La producción mundial de cobre refinado se estimó en 15,8 Mt en el 2006, con un déficit de 10,7 % frente a la demanda mundial proyectada de 17,7 Mt.[8] Los pórfidos cupríferos constituyen la principal fuente de extracción de cobre en el mundo.[9]
Nombres y símbolos
- Etimología
- La palabra «cobre» proviene del latín cuprum (con el mismo significado) y este a su vez de la expresión aes cyprium que significa literalmente «de Chipre» debido a la gran importancia que tuvieron las minas de cobre de la isla de Chipre en el mundo grecorromano.[10]
- Siglas y abreviaciones
- El símbolo químico actual del cobre es «Cu». Siglos atrás, los alquimistas lo representaron con el símbolo ♀ , que también representaba al planeta Venus, a la diosa griega Afrodita y al género femenino.[11] La razón de esta relación puede ser que la diosa fenicia Astarté, equivalente en parte a Afrodita, era muy venerada en Chipre, isla famosa por sus minas de cobre.[12] El símbolo ♀ guarda a su vez parecido con el jeroglífico egipcio anj, que representaba la vida o quizás también la unión sexual.[13] Sin embargo, en la mitología grecolatina la divinidad que presidía la fabricación de la moneda de cobre era Esculano.
- Adjetivo
- Las cualidades particulares del cobre, específicamente a lo referente a su color y lustre, han engendrado la raíz del calificativo cobrizo. La misma particularidad del material ha sido empleada al nombrar coloquialmente a algunas serpientes de India, Australia y Estados Unidos como «cabeza de cobre».
Historia
El cobre en la Antigüedad

El cobre es uno de los pocos metales que pueden encontrarse en la naturaleza en forma de cobre nativo, es decir, sin combinar con otros elementos. Por ello fue uno de los primeros en ser utilizado por el ser humano.[14] Los otros metales nativos son el oro, el platino, la plata y el hierro proveniente de meteoritos.
Se han encontrado utensilios de cobre nativo en torno al 7000 a. C. en Çayönü Tepesí (en la actual Turquía) y en Irak). El cobre de Çayönü Tepesí fue recocido pero el proceso aún no estaba perfeccionado.[14] En esta época, en Oriente Próximo también se utilizaban carbonatos de cobre (malaquita y azurita) con motivos ornamentales. En la región de los Grandes Lagos de América del Norte, donde abundaban los yacimientos de cobre nativo, desde el 4000 a. C. los indígenas acostumbraban a golpearlas hasta darles forma de punta de flecha, aunque nunca llegaron a descubrir la fusión.
Los primeros crisoles para producir cobre metálico a partir de carbonatos mediante reducciones con carbón datan del V milenio a. C.[14] Es el inicio de la llamada Edad del cobre, apareciendo crisoles en toda la zona entre los Balcanes e Irán, incluyendo Egipto. Se han encontrado pruebas de la explotación de minas de carbonatos de cobre desde épocas muy antiguas tanto en Tracia (Ai Bunar) como en la península del Sinaí.[15] De un modo endógeno, no conectado con las civilizaciones del Viejo Mundo, en la América precolombina, en torno al siglo IV a. C. la cultura Moche desarrolló la metalurgia del cobre ya refinado a partir de la malaquita y otros carbonatos cupríferos.
Hacia el 3500 a. C. la producción de cobre en Europa entró en declive a causa del agotamiento de los yacimientos de carbonatos. Por esta época se produjo la irrupción desde el este de unos pueblos, genéricamente denominados kurganes, que portaban una nueva tecnología: el uso del cobre arsenical. Esta tecnología, quizás desarrollada en Oriente Próximo o en el Cáucaso, permitía obtener cobre mediante la oxidación de sulfuro de cobre. Para evitar que el cobre se oxidase, se añadía arsénico al mineral. El cobre arsenical (a veces llamado también "bronce arsenical") era más cortante que el cobre nativo y además podía obtenerse de los muy abundantes yacimientos de sulfuros. Uniéndolo a la también nueva tecnología del molde de dos piezas, que permitía la producción en masa de objetos, los kurganes se equiparon de hachas de guerra y se extendieron rápidamente.[14]

Ötzi, el cadáver hallado en los Alpes y datado hacia el 3300 a. C., llevaba un hacha de cobre con un 99,7 % de cobre y un 0,22 % de arsénico.[16][17] De esta época data también el yacimiento de Los Millares (Almería, España), centro metalúrgico cercano a las minas de cobre de la sierra de Gádor.
No se sabe cómo ni dónde surgió la idea de añadir estaño al cobre, produciendo el primer bronce. Se cree que fue un descubrimiento imprevisto, ya que el estaño es más blando que el cobre y, sin embargo, al añadirlo al cobre se obtenía un material más duro cuyos filos se conservaban más tiempo.[14] El descubrimiento de esta nueva tecnología desencadenó el comienzo de la Edad del Bronce, fechado en torno a 3000 a. C. para Oriente Próximo, 2500 a. C. para Troya y el Danubio y 2000 a. C. para China. En el yacimiento de Bang Chian, en Tailandia, se han datado objetos de bronce anteriores al año 2000 a. C.[18] Durante muchos siglos el bronce tuvo un papel protagonista y cobraron gran importancia los yacimientos de estaño, a menudo alejados de los grandes centros urbanos de aquella época.
El declive del bronce empezó hacia el 1000 a. C., cuando surgió en Oriente Próximo una nueva tecnología que posibilitó la producción de hierro metálico a partir de minerales férreos. Las armas de hierro fueron reemplazando a las de cobre en todo el espacio entre Europa y Oriente Medio. En zonas como China la Edad del Bronce se prolongó varios siglos más. Hubo también regiones del mundo donde nunca llegó a utilizarse el bronce. Por ejemplo, el África subsahariana pasó directamente de la piedra al hierro.
Sin embargo, el uso del cobre y el bronce no desapareció durante la Edad del Hierro. Reemplazados en el armamento, estos metales pasaron a ser utilizados esencialmente en la construcción y en objetos decorativos como estatuas. El latón, una aleación de cobre y zinc fue inventado hacia el 600 a. C. También hacia esta época se fabricaron las primeras monedas en el estado de Lidia, en la actual Turquía. Mientras que las monedas más valiosas se acuñaron en oro y plata, las de uso más cotidiano se hicieron de cobre y bronce.[19]
La búsqueda de cobre y metales preciosos por el Mediterráneo condujo a los cartagineses a explotar el gran yacimiento de Río Tinto, en la actual provincia de Huelva. Tras las guerras púnicas los romanos se apoderaron de estas minas y las siguieron explotando hasta agotar todo el óxido de cobre. Debajo de él quedó una gran veta de sulfuro de cobre, el cual los romanos no sabían aprovechar eficazmente. A la caída del Imperio romano la mina había sido abandonada y solo fue reabierta cuando los andalusíes inventaron un proceso más eficaz para extraer el cobre del sulfuro.[19]
Edad Media y Edad Moderna
La resistencia a la corrosión del cobre, el bronce y el latón permitió que estos metales hayan sido utilizados no solo como decorativos sino también como funcionales desde la Edad Media hasta nuestros días. Entre los siglos X y XII se hallaron en Europa Central grandes yacimientos de plata y cobre, principalmente Rammelsberg y Joachimsthal. De ellos surgió una gran parte de la materia prima para realizar las grandes campanas, puertas y estatuas de las catedrales góticas europeas.[19] Además del uso bélico del cobre para la fabricación de objetos, como hachas, espadas, cascos o corazas; también se utilizó el cobre en la Edad Media en luminarias como candiles o candelabros; en braseros y en objetos de almacenamiento, como arcas o estuches.[20]
Los primeros cañones europeos de hierro forjado datan del siglo XIV, pero hacia el siglo XVI el bronce se impuso como el material casi único para toda la artillería y mantuvo ese dominio hasta bien entrado el siglo XIX.[21] En el Barroco, durante los siglos XVII y XVIII, el cobre y sus aleaciones adquirieron gran importancia en la construcción de obras monumentales, la producción de maquinaria de relojería y una amplia variedad de objetos decorativos y funcionales.[22] Las monarquías autoritarias del Antiguo Régimen utilizaron el cobre en aleación con la plata (denominada vellón) para realizar repetidas devaluaciones monetarias, llegando a la emisión de monedas puramente de cobre, características de las dificultades de la Hacienda de la Monarquía Hispánica del siglo XVII (que lo utilizó en tanta cantidad que tuvo que recurrir a importarlo de Suecia).[23]
Edad Contemporánea
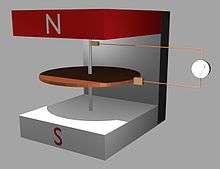
Durante 1831 y 1832, Michael Faraday descubrió que un conductor eléctrico moviéndose perpendicularmente a un campo magnético generaba una diferencia de potencial. Aprovechando esto, construyó el primer generador eléctrico, el disco de Faraday, empleando un disco de cobre que giraba entre los extremos de un imán con forma de herradura, induciendo una corriente eléctrica.[24] El posterior desarrollo de generadores eléctricos y su empleo en la historia de la electricidad ha dado lugar a que el cobre haya obtenido una importancia destacada en la humanidad, que ha aumentado su demanda notablemente.
Durante gran parte del siglo XIX, Gran Bretaña fue el mayor productor mundial de cobre, pero la importancia que fue adquiriendo el cobre motivó la explotación minera en otros países, llegando a destacarse la producción en Estados Unidos y Chile, además de la apertura de minas en África. De esta forma, en 1911 la producción mundial de cobre superó el millón de toneladas de cobre fino.
La aparición de los procesos que permitían la producción masiva de acero a mediados del siglo XIX, como el convertidor Thomas-Bessemer o el horno Martin-Siemens dio lugar a que se sustituyera el uso del cobre y de sus aleaciones en algunas aplicaciones determinadas donde se requería un material más tenaz y resistente. Sin embargo, el desarrollo tecnológico que siguió a la Revolución industrial en todas las ramas de la actividad humana y los adelantos logrados en la metalurgia del cobre han permitido producir una amplia variedad de aleaciones. Esto ha dado lugar a que se incrementen los campos de aplicación del cobre, lo cual, añadido al desarrollo económico de varios países, ha conllevado un notable aumento de la demanda mundial.
Estados Unidos
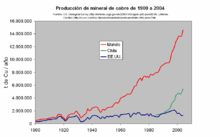
Desde principios del siglo XIX existió producción de cobre en los Estados Unidos, primero en Míchigan y más tarde en Arizona. Se trataba de pequeñas minas que explotaban mineral de alta ley.[25]
El desarrollo del proceso de flotación, más eficaz, hacia finales del siglo XIX permitió poner en explotación grandes yacimientos de baja ley, principalmente en Arizona, Montana y Utah. En pocos años Estados Unidos se convirtió en el primer productor mundial de cobre.[25]
En 1916 las minas estadounidenses produjeron por vez primera más de un millón de toneladas de cobre, representando en torno a las tres cuartas partes de la producción mundial. La producción minera bajó fuertemente a partir de la crisis de 1929, no solo por la reducción del consumo sino porque se disparó el reciclaje de metal. La demanda se recuperó a finales de los años 30, volviendo a superar las minas estadounidenses el millón de toneladas en 1940. Sin embargo, esta cifra ya representaba "solo" la mitad de la producción mundial y no llegaba a cubrir la demanda interna, por lo que en 1941 el país se convirtió por primera vez en importador neto de cobre.[26]
Desde los años 1950 hasta la actualidad la producción de Estados Unidos ha oscilado entre uno y dos millones de toneladas anuales, lo cual representa una fracción cada vez menor del total mundial (27 % en 1970, 17 % en 1980, 8 % en 2006). Mientras tanto, el consumo ha seguido creciendo continuamente y ello ha obligado a importar cantidades cada vez mayores de metal, superándose el millón de toneladas importadas por vez primera en 2001.[26]
Chile
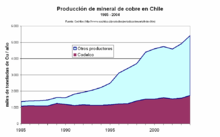
En 1810, año de su primera junta nacional, Chile producía unas 19 000 toneladas de cobre al año. A lo largo del siglo, la cifra fue creciendo hasta convertir al país en el primer productor y exportador mundial. Sin embargo, a finales del siglo XIX, comenzó un periodo de decadencia, debido por un lado al agotamiento de los yacimientos de alta ley y por otro al hecho de que la explotación del salitre acaparaba las inversiones mineras. En 1897, la producción había caído a 21 000 toneladas, casi lo mismo que en 1810.[27]
La situación cambió a comienzos del siglo XX, cuando grandes grupos mineros dotados de este país obtuvieron avances tecnológicos que permitieron la recuperación de cobre en yacimientos de baja concentración, iniciando la explotación de los yacimientos chilenos.[27]
El Estado chileno recibió pocos beneficios de la minería del cobre durante toda la primera mitad del siglo XX. La situación empezó a cambiar en 1951 con la firma del Convenio de Washington, que le permitió disponer del 20 % de la producción. En 1966, el Congreso Nacional de Chile impuso la creación de Sociedades Mineras Mixtas con las empresas extranjeras en las cuales el Estado tendría el 51 % de la propiedad de los yacimientos. El proceso de chilenización del cobre[28][29] culminó en julio de 1971, bajo el mandato de Salvador Allende, cuando el Congreso aprobó por unanimidad la nacionalización de la Gran Minería del cobre.[27][30]
[...] por exigirlo el interés nacional y en ejercicio del derecho soberano e inalienable del Estado de disponer libremente de sus riquezas y recursos naturales, se nacionalizan y declaran por tanto incorporadas al pleno y exclusivo dominio de la Nación las empresas extranjeras que constituyen la gran minería del cobre.Disposición transitoria agregada en 1971 al artículo 10.º de la Constitución de Chile.
En 1976, ya bajo la dictadura militar de Pinochet, el Estado fundó la Corporación Nacional del Cobre de Chile (Codelco) para gestionar las grandes minas de cobre.[27]
La mina de Chuquicamata, en la cual se han encontrado evidencias de la extracción de cobre por culturas precolombinas,[31] inició su construcción para la explotación industrial en 1910;[32] su explotación se inició el 18 de mayo de 1915.[33] Chuquicamata es la mina a cielo abierto más grande del mundo[34] y fue durante varios años la mina de cobre de mayor producción del mundo.[35] En 2002, se fusionaron las divisiones de Chuquicamata y Radomiro Tomic, creando el complejo minero Codelco Norte, que consta de dos minas a cielo abierto, Chuquicamata y Mina Sur. Aunque el yacimiento de Radomiro Tomic fue descubierto en los años 1950, sus operaciones comenzaron en 1995, una vez actualizados los estudios de viabilidad técnica y económica.[32]
En 1995, se inició la construcción de la mina de Minera Escondida, en la II Región de Antofagasta, y en 1998 se iniciaron las operaciones de extracción. Es la mina de mayor producción del mundo. La Huelga de la Minera Escondida en el 2006 paralizó la producción durante 25 días y alteró los precios mundiales del cobre.[36][37] La producción de Minera Escondida alcanzó en 2007 las 1 483 934 t.[38] Esta producción representa el 9,5 % de la producción mundial y el 26 % de la producción chilena de cobre, según estimaciones para 2007.[39]
En las últimas décadas, Chile se ha consolidado como el mayor productor mundial de cobre,[40] pasando del 14 % de la producción mundial en 1960 al 36 % en 2006.[41]
Isótopos
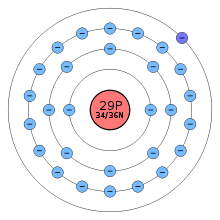
En la naturaleza se encuentran dos isótopos estables: 63Cu y 65Cu. El más ligero de ellos es el más abundante (69,17 %). Se han caracterizado hasta el momento 25 isótopos radiactivos de los cuales los más estables son el 67Cu, el 64Cu y el 61Cu con periodos de semidesintegración de 61,83 horas, 12,70 horas y 3,333 horas respectivamente. Los demás radioisótopos, con masas atómicas desde 54,966 uma (55Cu) a 78,955 uma (79Cu), tienen periodos de semidesintegración inferiores a 23,7 minutos y la mayoría no alcanzan los 30 segundos. Los isótopos 68Cu y 70Cu presentan estados metaestables con un periodo de semidesintegración mayor al del estado fundamental.
Los isótopos más ligeros que el 63Cu estable se desintegran principalmente por emisión beta positiva, originando isótopos de níquel, mientras que los más pesados que el isótopo 65Cu estable se desintegran por emisión beta negativa dando lugar a isótopos de cinc. El isótopo 64Cu se desintegra generando 64Zn, por captura electrónica y emisión beta positiva en un 69 % y por desintegración beta negativa genera 64Ni en el 31 % restante.[42]
Propiedades y características del cobre
Propiedades físicas
El cobre posee varias propiedades físicas que propician su uso industrial en múltiples aplicaciones, siendo el tercer metal, después del hierro y del aluminio, más consumido en el mundo. Es de color rojizo y de brillo metálico y, después de la plata, es el elemento con mayor conductividad eléctrica y térmica. Es un material abundante en la naturaleza; tiene un precio accesible y se recicla de forma indefinida; forma aleaciones para mejorar las prestaciones mecánicas y es resistente a la corrosión y oxidación.
La conductividad eléctrica del cobre puro fue adoptada por la Comisión Electrotécnica Internacional en 1913 como la referencia estándar para esta magnitud, estableciendo el International Annealed Copper Standard (Estándar Internacional del Cobre Recocido) o IACS. Según esta definición, la conductividad del cobre recocido medida a 20 °C es igual a 5,80 × 107 S/m.[43] A este valor de conductividad se le asigna un índice 100 % IACS y la conductividad del resto de los materiales se expresa en porcentaje de IACS. La mayoría de los metales tienen valores de conductividad inferiores a 100 % IACS pero existen excepciones como la plata o los cobres especiales de muy alta conductividad designados C-103 y C-110.[44]
Propiedades mecánicas
Tanto el cobre como sus aleaciones tienen una buena maquinabilidad, es decir, son fáciles de mecanizar. El cobre posee muy buena ductilidad y maleabilidad lo que permite producir láminas e hilos muy delgados y finos. Es un metal blando, con un índice de dureza 3 en la escala de Mohs (50 en la escala de Vickers) y su resistencia a la tracción es de 210 MPa, con un límite elástico de 33,3 MPa.[2] Admite procesos de fabricación de deformación como laminación o forja, y procesos de soldadura y sus aleaciones adquieren propiedades diferentes con tratamientos térmicos como temple y recocido. En general, sus propiedades mejoran con bajas temperaturas lo que permite utilizarlo en aplicaciones criogénicas.
Características químicas

En la mayoría de sus compuestos, el cobre presenta estados de oxidación bajos, siendo el más común el +2, aunque también existen algunos con estado de oxidación +1.
Expuesto al aire, el color rojo salmón, inicial se torna rojo violeta por la formación de óxido cuproso (Cu2O) para ennegrecerse posteriormente por la formación de óxido cúprico (CuO).[45] La coloración azul del Cu+2 se debe a la formación del ion [Cu (OH2)6]+2.[46]
Expuesto largo tiempo al aire húmedo, forma una capa adherente e impermeable de carbonato básico (carbonato cúprico) de color verde y venenoso.[47] También pueden formarse pátinas de cardenillo, una mezcla venenosa de acetatos de cobre de color verdoso o azulado que se forma cuando los óxidos de cobre reaccionan con ácido acético,[48] que es el responsable del sabor del vinagre y se produce en procesos de fermentación acética. Al emplear utensilios de cobre para la cocción de alimentos, deben tomarse precauciones para evitar intoxicaciones por cardenillo que, a pesar de su mal sabor, puede ser enmascarado con salsas y condimentos y ser ingerido.
Los halógenos atacan con facilidad al cobre, especialmente en presencia de humedad. En seco, el cloro y el bromo no producen efecto y el flúor solo le ataca a temperaturas superiores a 500 °C.[45] El cloruro cuproso y el cloruro cúprico, combinados con el oxígeno y en presencia de humedad producen ácido clorhídrico, ocasionando unas manchas de atacamita o paratacamita, de color verde pálido a azul verdoso, suaves y polvorientas que no se fijan sobre la superficie y producen más cloruros de cobre, iniciando de nuevo el ciclo de la erosión.[49]
Los ácidos oxácidos atacan al cobre, por lo cual se utilizan estos ácidos como decapantes (ácido sulfúrico) y abrillantadores (ácido nítrico). El ácido sulfúrico reacciona con el cobre formando un sulfuro, CuS (covelina) o Cu2S (calcocita) de color negro y agua. También pueden formarse sales de sulfato cúprico (antlerita) con colores de verde a azul verdoso.[49] Estas sales son muy comunes en los ánodos de los acumuladores de plomo que se emplean en los automóviles.
El ácido cítrico disuelve el óxido de cobre, por lo que se aplica para limpiar superficies de cobre, lustrando el metal y formando citrato de cobre. Si después de limpiar el cobre con ácido cítrico, se vuelve a utilizar el mismo paño para limpiar superficies de plomo, el plomo se bañará de una capa externa de citrato de cobre y citrato de plomo con un color rojizo y negro.
Propiedades biológicas
En las plantas, el cobre posee un importante papel en el proceso de la fotosíntesis y forma parte de la composición de la plastocianina. Alrededor del 70 % del cobre de una planta está presente en la clorofila, principalmente en los cloroplastos. Los primeros síntomas en las plantas por deficiencia de cobre aparecen en forma de hojas estrechas y retorcidas, además de puntas blanquecinas. Las panículas y las vainas pueden aparecer vacías por una deficiencia severa de cobre, ocasionando graves pérdidas económicas en la actividad agrícola.[50]
El cobre contribuye a la formación de glóbulos rojos y al mantenimiento de los vasos sanguíneos, nervios, sistema inmunitario y huesos y por tanto es esencial para la vida humana.[51] El cobre se encuentra en algunas enzimas como la citocromo c oxidasa, la lisil oxidasa y la superóxido dismutasa.[6]
El desequilibrio de cobre en el organismo cuando se produce en forma excesiva ocasiona una enfermedad hepática conocida como enfermedad de Wilson, el origen de esta enfermedad es hereditario, y aparte del trastorno hepático que ocasiona también daña al sistema nervioso. Se trata de una enfermedad poco común.[7]
Puede producirse deficiencia de cobre en niños con una dieta pobre en calcio, especialmente si presentan diarreas o desnutrición. También hay enfermedades que disminuyen la absorción de cobre, como la enfermedad celiaca, la fibrosis quística o al llevar dietas restrictivas.[52]
El cobre se encuentra en una gran cantidad de alimentos habituales de la dieta tales como ostras, mariscos, legumbres, vísceras y nueces entre otros, además del agua potable y por lo tanto es muy raro que se produzca una deficiencia de cobre en el organismo.
Precauciones sanitarias del cobre
A pesar de que el cobre es un oligoelemento necesario para la vida, unos niveles altos de este elemento en el organismo pueden ser dañinos para la salud. La inhalación de niveles altos de cobre puede producir irritación de las vías respiratorias. La ingestión de niveles altos de cobre puede producir náuseas, vómitos y diarrea. Un exceso de cobre en la sangre puede dañar el hígado y los riñones, e incluso causar la muerte.[53] Ingerir por vía oral una cantidad de 30 g de sulfato de cobre es potencialmente letal en los humanos.
Para las actividades laborales en las que se elaboran y manipulan productos de cobre, es necesario utilizar medidas de protección colectiva que protejan a los trabajadores. El valor límite tolerado es de 0,2 mg/m³ para el humo y 1 mg/m³ para el polvo y la niebla. El cobre reacciona con oxidantes fuertes tales como cloratos, bromatos y yoduros, originando un peligro de explosión. Además puede ser necesario el uso de equipos de protección individual como guantes, gafas y mascarillas. Además, puede ser recomendable que los trabajadores se duchen y se cambien de ropa antes de volver a su casa cada día.[53]
La Organización Mundial de la Salud (OMS) en su Guía de la calidad del agua potable recomienda un nivel máximo de 2 mg/l.[54] El mismo valor ha sido adoptado en la Unión Europea como valor límite de cobre en el agua potable, mientras que en Estados Unidos la Agencia de Protección Ambiental ha establecido un máximo de 1,3 mg/l.[55] El agua con concentraciones de cobre superiores a 1 mg/l puede ensuciar la ropa al lavarla y presentar un sabor metálico desagradable.[55][56] La Agencia para Sustancias Tóxicas y el Registro de Enfermedades de Estados Unidos recomienda que, para disminuir los niveles de cobre en el agua potable que se conduce por tuberías de cobre, se deje correr el agua por lo menos 15 segundos antes de beberla o usarla por primera vez en la mañana.[53]
Las actividades mineras pueden provocar la contaminación de ríos y aguas subterráneas con cobre y otros metales durante su explotación así como una vez abandonada la minería en la zona. El color turquesa del agua y las rocas se debe a la acción que el cobre y otros metales desarrollan durante su explotación minera.[57] [58]
Aleaciones y tipos de cobre
Desde el punto de vista físico, el cobre puro posee muy bajo límite elástico (33 MPa) y una dureza escasa (3 en la escala de Mohs o 50 en la escala de Vickers).[2] En cambio, unido en aleación con otros elementos adquiere características mecánicas muy superiores, aunque disminuye su conductividad. Existe una amplia variedad de aleaciones de cobre, de cuyas composiciones dependen las características técnicas que se obtienen, por lo que se utilizan en multitud de objetos con aplicaciones técnicas muy diversas. El cobre se alea principalmente con los siguientes elementos: Zn, Sn, Al, Ni, Be, Si, Cd, Cr y otros en menor cuantía.
Según los fines a los que se destinan en la industria, se clasifican en aleaciones para forja y en aleaciones para moldeo. Para identificarlas tienen las siguientes nomenclaturas generales según la norma ISO 1190-1:1982 o su equivalente UNE 37102:1984.[59] Ambas normas utilizan el sistema UNS (del inglés Unified Numbering System).[60]
Latón (Cu-Zn)

El latón, también conocido como cuzin, es una aleación de cobre, cinc (Zn) y, en menor proporción, otros metales. Se obtiene mediante la fundición de sus componentes en un crisol o mediante la fundición y reducción de menas sulfurosas en un horno de reverbero o de cubilote. En los latones industriales, el porcentaje de Zn se mantiene siempre inferior a 50 %. Su composición influye en las características mecánicas, la fusibilidad y la capacidad de conformación por fundición, forja y mecanizado. En frío, los lingotes obtenidos se deforman plásticamente produciendo láminas, varillas o se cortan en tiras susceptibles de estirarse para fabricar alambres. Su densidad depende de su composición y generalmente ronda entre 8,4 g/cm³ y 8,7 g/cm³.
Las características de los latones dependen de la proporción de elementos que intervengan en la aleación de tal forma que algunos tipos de latón son maleables únicamente en frío, otros exclusivamente en caliente, y algunos no lo son a ninguna temperatura. Todos los tipos de latones se vuelven quebradizos cuando se calientan a una temperatura próxima al punto de fusión.
El latón es más duro que el cobre, pero fácil de mecanizar, grabar y fundir. Es resistente a la oxidación, a las condiciones salinas y es maleable, por lo que puede laminarse en planchas finas. Su maleabilidad varía la temperatura y con la presencia, incluso en cantidades mínimas, de otros metales en su composición.
Un pequeño aporte de plomo en la composición del latón mejora la maquinabilidad porque facilita la fragmentación de las virutas en el mecanizado. El plomo también tiene un efecto lubricante por su bajo punto de fusión, lo que permite ralentizar el desgaste de la herramienta de corte.
El latón admite pocos tratamientos térmicos y únicamente se realizan recocidos de homogeneización y recristalización. El latón tiene un color amarillo brillante, con parecido al oro, característica que es aprovechada en joyería, especialmente en bisutería, y en el galvanizado de elementos decorativos. Las aplicaciones de los latones abarcan otros campos muy diversos, como armamento, calderería, soldadura, fabricación de alambres, tubos de condensadores y terminales eléctricos. Como no es atacado por el agua salada, se usa también en las construcciones de barcos y en equipos pesqueros y marinos.
El latón no produce chispas por impacto mecánico, una propiedad atípica en las aleaciones. Esta característica convierte al latón en un material importante en la fabricación de envases para la manipulación de compuestos inflamables, cepillos de limpieza de metales y en pararrayos.
Bronce (Cu-Sn)
.jpg)
Las aleaciones en cuya composición predominan el cobre y el estaño (Sn) se conocen con el nombre de bronce y son conocidas desde la antigüedad. Hay muchos tipos de bronces que contienen además otros elementos como aluminio, berilio, cromo o silicio. El porcentaje de estaño en estas aleaciones está comprendido entre el 2 y el 22 %. Son de color amarillento y las piezas fundidas de bronce son de mejor calidad que las de latón, pero son más difíciles de mecanizar y más caras.
La tecnología metalúrgica de la fabricación de bronce es uno de los hitos más importantes de la historia de la humanidad pues dio origen a la llamada Edad de Bronce. El bronce fue la primera aleación fabricada voluntariamente por el ser humano: se realizaba mezclando el mineral de cobre (calcopirita, malaquita, etc.) y el de estaño (casiterita) en un horno alimentado con carbón vegetal. El resultante de la combustión del carbón, que se oxidaba formando anhídrido carbónico, producía la reducción los minerales de cobre y estaño a metales. El cobre y el estaño que se fundían, se aleaban entre un 5 y un 10 % en peso de estaño.
El bronce se emplea especialmente en aleaciones conductoras del calor, en baterías eléctricas y en la fabricación de válvulas, tuberías y uniones de fontanería. Algunas aleaciones de bronce se usan en uniones deslizantes, como cojinetes y descansos, discos de fricción; y otras aplicaciones donde se requiere alta resistencia a la corrosión como rodetes de turbinas o válvulas de bombas, entre otros elementos de máquinas. En algunas aplicaciones eléctricas es utilizado en resortes.
Alpaca (Cu-Ni-Zn)

Las alpacas o platas alemanas son aleaciones de cobre, níquel (Ni) y zinc (Zn), en una proporción de 50-70 % de cobre, 13-25 % de níquel, y 13-25 % de zinc.[61] Sus propiedades varían de forma continua en función de la proporción de estos elementos en su composición, pasando de máximos de dureza a mínimos de conductividad. Estas aleaciones tienen la propiedad de rechazar los organismos marinos (antifouling). Si a estas aleaciones de cobre-níquel-zinc se les añaden pequeñas cantidades de aluminio o hierro constituyen aleaciones que se caracterizan por su resistencia a la corrosión marina, por lo que se utilizan ampliamente en la construcción naval, principalmente en condensadores y tuberías, así como en la fabricación de monedas y de resistencias eléctricas.[62]
Las aleaciones de alpaca tienen una buena resistencia a la corrosión y buenas cualidades mecánicas. Su aplicación se abarca materiales de telecomunicaciones, instrumentos y accesorios de fontanería y electricidad, como grifos, abrazaderas, muelles, conectores. También se emplea en la construcción y ferretería, para elementos decorativos y en las industrias químicas y alimentarias, además de materiales de vajillas y orfebrería.[63]
El monel es una aleación que se obtiene directamente de minerales canadienses y tiene una composición de Cu=28-30 %, Ni=66-67 %, Fe=3-3,5 %. Este material tiene gran resistencia a los agentes corrosivos y a las altas temperaturas.[64]
Otro tipo de alpaca es el llamado platinoide, aleación de color blanco compuesta de 60 % de cobre,14 % de níquel, 24 % de cinc y de 1-2 % de wolframio.[65]
Otras aleaciones
Otras aleaciones de cobre con aplicaciones técnicas son las siguientes:
- Cobre-cadmio (Cu-Cd)
- Son aleaciones de cobre con un pequeño porcentaje de cadmio y tienen con mayor resistencia que el cobre puro. Se utilizan en líneas eléctricas aéreas sometidas a fuertes solicitaciones mecánicas como catenarias y cables de contacto para tranvías.
- Cobre-cromo (Cu-Cr) y Cobre-cromo-circonio (Cu-Cr-Zr)
- Tienen una alta conductividad eléctrica y térmica. Se utilizan en electrodos de soldadura por resistencia, barras de colectores, contactores de potencia, equipos siderúrgicos y resortes conductores.
- Cobre-hierro-fósforo (Cu-Fe-P)
- Para la fabricación de elementos que requieran una buena conductividad eléctrica y buenas propiedades térmicas y mecánicas se añaden al cobre partículas de hierro y fósforo. Estas aleaciones se utilizan en circuitos integrados porque tienen una buena conductividad eléctrica, buenas propiedades mecánicas y tienen una alta resistencia a la temperatura.[66]
- Cobre-aluminio (Cu-Al)
- También conocidas como bronces al aluminio y duraluminio, contienen al menos un 10 % de aluminio. Estas aleaciones son muy parecidas al oro y muy apreciadas para trabajos artísticos. Tienen buenas propiedades mecánicas y una elevada resistencia a la corrosión. Se utilizan también para los trenes de aterrizaje de los aviones, en ciertas construcciones mecánicas.[67]
- Cobre-berilio (Cu-Be)
- Es una aleación constituida esencialmente por cobre. Esta aleación tiene importantes propiedades mecánicas y gran resistencia a la corrosión. Se utiliza para fabricar muelles, moldes para plásticos, electrodos para soldar por resistencia y herramientas antideflagrantes.[68]
- Cobre-plata (Cu-Ag) o cobre a la plata
- Es una aleación débil por su alto contenido de cobre, que se caracteriza por una alta dureza que le permite soportar temperaturas de hasta 226 °C, manteniendo la conductividad eléctrica del cobre.[69]
- Constantán (Cu55Ni45)
- Es una aleación formada por un 55 % de cobre y un 45 % de níquel. Se caracteriza por tener un una resistividad eléctrica de 4,9•10−7 Ω•m casi constante en un amplio rango de temperaturas, con un coeficiente de temperatura de 10−5 K−1. Se emplea en la fabricación de termopares, galgas extensiométricas y monedas.
- Manganina (Cu86Mn12Ni2)
- Es otra aleación con un muy bajo coeficiente de temperatura y se utiliza en galgas extensiométricas y resistores de alta estabilidad. Además, su potencial termoeléctrico de contacto con el cobre por efecto Seebeck es muy pequeño (+0,6 mV/100 K). Su resistividad eléctrica es de unos 4,9•10−7 Ω•m y su coeficiente de temperatura es de 10−8 K−1.[70]
Algunas aleaciones de cobre tienen pequeños porcentajes de azufre y de plomo que mejoran la maquinabilidad de la aleación. Tanto el plomo como el azufre tienen muy baja solubilidad en el cobre, separándose respectivamente como plomo (Pb) y como sulfuro cuproso (Cu2S) en los bordes de grano y facilitando la rotura de las virutas en los procesos de mecanizado, mejorando la maquinabilidad de la aleación.[66]
Procesos industriales del cobre
Minería del cobre


El cobre nativo suele acompañar a sus minerales en bolsas que afloran a la superficie explotándose en minas a cielo abierto. El cobre se obtiene a partir de minerales sulfurados (80 %) y de minerales oxidados (20 %), los primeros se tratan por un proceso denominado pirometalurgia y los segundos por otro proceso denominado hidrometalurgia.[71] Generalmente en la capa superior se encuentran los minerales oxidados (cuprita, melaconita), junto a cobre nativo en pequeñas cantidades, lo que explica su elaboración milenaria ya que el metal podía extraerse fácilmente en hornos de fosa. A continuación, por debajo del nivel freático, se encuentran las piritas (sulfuros) primarias calcosina (Cu2S) y covellina (CuS) y finalmente las secundarias calcopirita (FeCuS2) cuya explotación es más rentable que la de las anteriores. Acompañando a estos minerales se encuentran otros como la bornita (Cu5FeS4), los cobres grises y los carbonatos azurita y malaquita que suelen formar masas importantes en las minas de cobre por ser la forma en la que usualmente se alteran los sulfuros.
La tecnología de obtención del cobre está muy bien desarrollada aunque es laboriosa debido a la pobreza de la ley de los minerales. Los yacimientos de cobre contienen generalmente concentraciones muy bajas del metal. Esta es la causa de que muchas de las distintas fases de producción tengan por objeto la eliminación de impurezas.[72]
Metalurgia del cobre


La metalurgia del cobre depende de que el mineral se presente en forma de sulfuros o de óxidos (cuproso u cúprico).
Pirometalurgia
Para los sulfuros se utiliza para producir cátodos la vía llamada pirometalurgia, que consiste en el siguiente proceso: Conminución del mineral -> Concentración (flotación) -> fundición en horno -> paso a convertidores -> afino -> moldeo de ánodos -> electrorefinación -> cátodo. El proceso de refinado produce unos cátodos con un contenido del 99,9 % de cobre. Los cátodos son unas planchas de un metro cuadrado y un peso de 55 kg.
Otros componentes que se obtienen de este proceso son hierro (Fe) y azufre (S), además de muy pequeñas cantidades de plata (Ag) y oro (Au). Como impurezas del proceso se extraen también plomo (Pb), arsénico (As) y mercurio (Hg).
Como regla general una instalación metalúrgica de cobre que produzca 300.000 t/año de ánodos, consume 1.000.000 t/año de concentrado de cobre y como subproductos produce 900.000 t/año de ácido sulfúrico y 300.000 t/año de escorias.[73]
Hidrometalurgia
Cuando se trata de aprovechar los residuos minerales, la pequeña concentración de cobre que hay en ellos se encuentra en forma de óxidos y sulfuros, y para recuperar ese cobre se emplea la tecnología llamada hidrometalurgia, más conocida por su nomenclatura anglosajona Sx-Ew.
El proceso que sigue esta técnica es el siguiente: Mineral de cobre-> lixiviación-> extracción-> electrólisis-> cátodo
Esta tecnología se utiliza muy poco porque la casi totalidad de concentrados de cobre se encuentra formando sulfuros, siendo la producción mundial estimada de recuperación de residuos en torno al 15 % de la totalidad de cobre producido.[73][74]
Tratamientos térmicos del cobre

El cobre y sus aleaciones permiten determinados tratamientos térmicos para fines muy determinados siendo los más usuales los de recocido, refinado y temple.
El cobre duro recocido se presenta muy bien para operaciones en frío como son: doblado, estampado y embutido. El recocido se produce calentando el cobre o el latón a una temperatura adecuada en un horno eléctrico de atmósfera controlada, y luego se deja enfriar al aire. Hay que procurar no superar la temperatura de recocido porque entonces se quema el cobre y se torna quebradizo y queda inutilizable.
El refinado es un proceso controlado de oxidación seguida de una reducción. El objetivo de la oxidación es eliminar las impurezas contenidas en el cobre, volatilizándolas o reduciéndolas a escorias. A continuación la reducción es mejorar la ductilidad y la maleabilidad del material.[75]
Los tratamientos térmicos que se realizan a los latones son principalmente recocidos de homogeneización, recristalización y estabilización. Los latones con más del 35 % de Zn pueden templarse para hacerlos más blandos.
Los bronces habitualmente se someten a tratamientos de recocidos de homogeneización para las aleaciones de moldeo; y recocidos contra dureza y de recristalización para las aleaciones de forja. El temple de los bronces de dos elementos constituyentes es análogo al templado del acero: se calienta a unos 600 °C y se enfría rápidamente. Con esto se consigue disminuir la dureza del material, al contrario de lo que sucede al templar acero y algunos bronces con más de dos componentes.[76]
Aplicaciones y usos del cobre
Ya sea considerando la cantidad o el valor del metal empleado, el uso industrial del cobre es muy elevado. Es un material importante en multitud de actividades económicas y ha sido considerado un recurso estratégico en situaciones de conflicto.
Cobre metálico
El cobre se utiliza tanto con un gran nivel de pureza, cercano al 100 %, como aleado con otros elementos. El cobre puro se emplea principalmente en la fabricación de cables eléctricos.
Electricidad y telecomunicaciones

El cobre es el metal no precioso con mejor conductividad eléctrica. Esto, unido a su ductilidad y resistencia mecánica, lo han convertido en el material más empleado para fabricar cables eléctricos, tanto de uso industrial como residencial. Asimismo se emplean conductores de cobre en numerosos equipos eléctricos como generadores, motores y transformadores. La principal alternativa al cobre en estas aplicaciones es el aluminio.[41]
También son de cobre la mayoría de los cables telefónicos, los cuales además posibilitan el acceso a Internet. Las principales alternativas al cobre para telecomunicaciones son la fibra óptica y los sistemas inalámbricos. Por otro lado, todos los equipos informáticos y de telecomunicaciones contienen cobre en mayor o menor medida, por ejemplo en sus circuitos integrados, transformadores y cableado interno.[41]
Medios de transporte
El cobre se emplea en varios componentes de coches y camiones, principalmente los radiadores (gracias a su alta conductividad térmica y resistencia a la corrosión), frenos y cojinetes, además naturalmente de los cables y motores eléctricos. Un coche pequeño contiene en total en torno a 20 kg de cobre, subiendo esta cifra a 45 kg para los de mayor tamaño.[41]
También los trenes requieren grandes cantidades de cobre en su construcción: 1 - 2 toneladas en los trenes tradicionales y hasta 4 toneladas en los de alta velocidad. Además las catenarias contienen unas 10 toneladas de cobre por kilómetro en las líneas de alta velocidad.[10]
Por último, los cascos de los barcos incluyen a menudo aleaciones de cobre y níquel para reducir el ensuciamiento producido por los seres marinos.
Construcción y ornamentación

Una gran parte de las redes de transporte de agua están hechas de cobre o latón,[77] debido a su resistencia a la corrosión y sus propiedades anti-bacterianas, habiendo quedado las tuberías de plomo en desuso por sus efectos nocivos para la salud humana. Frente a las tuberías de plástico, las de cobre tienen la ventaja de que no arden en caso de incendio y por tanto no liberan humos y gases potencialmente tóxicos.[41]
El cobre y, sobre todo, el bronce se utilizan también como elementos arquitectónicos y revestimientos en tejados, fachadas, puertas y ventanas. El cobre se emplea también a menudo para los pomos de las puertas de locales públicos, ya que sus propiedades anti-bacterianas evitan la propagación de epidemias.[41]
Dos aplicaciones clásicas del bronce en la construcción y ornamentación son la realización de estatuas y de campanas.
El sector de la construcción consume actualmente (2008) el 26 % de la producción mundial de cobre.[10]
Monedas
Desde el inicio de la acuñación de monedas en la Edad Antigua el cobre se emplea como materia prima de las mismas, a veces puro y, más a menudo, en aleaciones como el bronce y el cuproníquel.
Ejemplos de monedas que incluyen cobre puro:
- Las monedas de uno, dos y cinco céntimos de euro son de acero recubierto de cobre.[78] La moneda de un centavo de dólar estadounidense es de cinc recubierto de cobre.[79]
Ejemplos de monedas de cuproníquel:
- Disco interior de la moneda de un euro y parte exterior de la moneda de dos euros.[78] Monedas de 25 y 50 céntimos de dólar estadounidense.[79] Monedas españolas de 5, 10, 25, 50 y 200 pesetas acuñadas desde 1949.[80]
Ejemplos de monedas de otras aleaciones de cobre:
Otras aplicaciones
El cobre participa en la materia prima de una gran cantidad de diferentes y variados componentes de todo tipo de maquinaria, tales como casquillos, cojinetes, embellecedores, etc. Forma parte de los elementos de bisutería, bombillas y tubos fluorescentes, calderería, electroimanes, monedas, instrumentos musicales de viento, microondas, sistemas de calefacción y aire acondicionado.[81] El cobre, el bronce y el latón son aptos para tratamientos de galvanizado para cubrir otros metales.
Cobre no metálico
El sulfato de cobre (II) también conocido como sulfato cúprico es el compuesto de cobre de mayor importancia industrial y se emplea como abono y pesticida en agricultura, alguicida en la depuración del agua y como conservante de la madera.
El sulfato de cobre está especialmente indicado para suplir funciones principales del cobre en la planta, en el campo de las enzimas: oxidasas del ácido ascórbico, polifenol, citocromo, etc. También forma parte de la plastocianina contenida en los cloroplastos y que participa en la cadena de transferencia de electrones de la fotosíntesis. Su absorción se realiza mediante un proceso activo metabólicamente. Prácticamente no es afectado por la competencia de otros cationes pero, por el contrario, afecta a los demás cationes. Este producto puede ser aplicado a todo tipo de cultivo y en cualquier zona climática en invernaderos.[82]
Para la decoración de azulejos y cerámica, se realizan vidriados que proporcionan un brillo metálico de diferentes colores. Para decorar la pieza una vez cocida y vidriada, se aplican mezclas de óxidos de cobre y otros materiales y después se vuelve a cocer la pieza a menor temperatura.[83] Al mezclar otros materiales con los óxidos de cobre pueden obtenerse diferentes tonalidades.[84] Para las decoraciones de cerámica, también se emplean películas metálicas de plata y cobre en mezclas coloidales (cobre coloidal) de barnices cerámicos que proporcionan tonos parecidos a las irisaciones metálicas del oro o del cobre.[85][86]
Un pigmento muy utilizado en pintura para los tonos verdes es el cardenillo, también conocido en este ámbito como verdigris, que consiste en una mezcla formada principalmente por acetatos de cobre, que proporciona tonos verdosos o azulados.[87]
Productos del cobre
Fundición: blíster y ánodos
El cobre blíster, también llamado ampollado o anódico, tiene una pureza de entre 98 y 99,5 %, y su principal aplicación es la fabricación por vía electrolítica de cátodos de cobre, cuya pureza alcanza el 99,99 %. También se puede emplear para sintetizar sulfato de cobre y otros productos químicos. Su principal aplicación es su transformación en ánodos de cobre.[88]
El paso intermedio en la transformación de cobre blíster en cátodos de cobre es la producción de ánodos de cobre, con cerca de 99,6 % de pureza. Un ánodo de cobre tiene unas dimensiones aproximadas de 100x125 cm, un grosor de 5 cm y un peso aproximado de 350 kg.
Refinería: cátodos
El cátodo de cobre constituye la materia prima idónea para la producción de alambrón de cobre de altas especificaciones. Es un producto, con un contenido superior al 99,99 % de cobre, es resultante del refino electrolítico de los ánodos de cobre. Su calidad está dentro de la denominación Cu-CATH-01 bajo la norma EN 1978:1998. Se presenta en paquetes corrugados y flejes, cuya plancha tiene unas dimensiones de 980x930 mm y un grosor de 7 mm con un peso aproximado de 47 kg. Su uso fundamental es la producción de alambrón de cobre de alta calidad, aunque también se utiliza para la elaboración de otros semitransformados de alta exigencia.[89]
Subproductos de fundición y refinería
Después del proceso de elaborar ánodo de cobre y cátodo de cobre se obtienen los siguientes subproductos: Ácido sulfúrico. Escoria granulada. Lodos electrolíticos. Sulfato de níquel. Yeso
Alambrón
El alambrón de cobre es un producto resultante de la transformación de cátodo en la colada continua. Su proceso de producción se realiza según las normas ASTM B49-92 y EN 1977.
Las características esenciales del alambrón producido por la empresa Atlantic-copper son:[90]
- Diámetro y tolerancia: 8 mm ± 0,4 mm. Cu: 99,97 % min. Oxígeno: 200 ppm. Conductividad eléctrica: > 101 % (IACS. Test de elongación espiral: > 450 m (200 °C)
El alambrón se comercializa en bobinas flejadas sobre palet de madera y protegidas con funda de plástico. Cuyas dimensiones son: Peso bobina 5000 kg, diámetro exterior 1785 mm, diámetro interior 1150 mm y altura 900 mm. Las aplicaciones del alambrón son para la fabricación de cables eléctricos que requieran una alta calidad, ya sean esmaltados o multifilares de diámetros de 0,15/0,20 mm.
Alambre de cobre desnudo

El alambre de cobre desnudo se produce a partir del alambrón y mediante un proceso de desbaste y con un horno de recocido. Se obtiene alambre desnudo formado por un hilo de cobre electrolítico en tres temples, duro, semiduro y suave y se utiliza para usos eléctricos se produce en una gama de diámetros de 1 mm a 8 mm y en bobinas que pueden pesar del orden de 2250 kg. Este alambre se utiliza en líneas aéreas de distribución eléctrica, en neutros de subestaciones, conexiones a tierra de equipos y sistemas y para fabricar hilos planos, esmaltados y multifilares que pueden tener un diámetros de 0,25/0,22 mm. Está fabricado a base de cobre de alta pureza con un contenido mínimo de 99,9 % de Cu. Este tipo de alambre tiene una alta conductividad, ductilidad y resistencia mecánica así como gran resistencia a la corrosión en ambientes salobres.[91]
Trefilado
Se denomina trefilado al proceso de adelgazamiento del cobre a través del estiramiento mecánico que se ejerce al mismo al partir de alambrón de 6 u 8 mm de diámetro con el objetivo de producir cables eléctricos flexibles con la sección requerida. Un cable eléctrico se compone de varios hilos que mediante un proceso de extrusión se le aplica el aislamiento exterior con un compuesto plástico de PVC o polietileno. Generalmente el calibre de entrada es de 6 a 8 mm, para luego adelgazarlo al diámetro requerido. Como el trefilado es un proceso continuo se van formando diferentes bobinas o rollos que van siendo cortados a las longitudes requeridas o establecidos por las normas y son debidamente etiquetados con los correspondientes datos técnicos del cable.
Se llama apantallado al cubrimiento de un conductor central debidamente aislado por varios hilos conductores de cobre, que entrelazados alrededor forman una pantalla. Cuando es necesario aislar un hilo conductor mediante esmaltado se le aplica una capa de barniz (poliesterimida). Estas mezclas de resinas son usadas para recubrir el conductor metálico quedando aislados del medio ambiente que lo rodea y logrando de esta forma conducir el flujo eléctrico sin problemas.[92]
Tubos

Un tubo es un producto hueco, de sección normalmente redonda, que tiene una periferia continua y que es utilizado en gasfitería, fontanería y sistemas mecánicos para el transporte de líquidos o gases. Los tubos de cobre se utilizan masivamente en edificios residenciales, comerciales e industriales.
Para la fabricación de tubo se parte, por lo general, de una mezcla de cobre refinado y de chatarra de calidad controlada, que se funde en un horno. De la colada de cobre se obtienen lingotes conocidos como «billets», que tienen forma cilíndrica, unos 300 mm de diámetro y 8 m de largo y un peso de unas 5 toneladas.[93] Los tubos sin costura se fabrican a partir de estos lingotes mediante las operaciones siguientes:
- Corte de los lingotes en piezas de unos 700 mm de largo.
- Calentamiento en horno de túnel a entre 800 y 900 °C.
- Extrusión a alta temperatura, por la cual se obtiene en una sola pasada una pieza o pretubo de gran diámetro con paredes muy gruesas. La máquina en la que se realiza esta operación se denomina "extrusor" y consiste de un "mandril" que aprieta el lingote caliente hasta hacerlo pasar a través de una matriz calibrada. Durante la extrusión, el cobre sufre una oxidación superficial que puede perjudicar las operaciones posteriores.
- Laminación en frío, que reduce el grosor de la pared del tubo, conservando su sección circular. Se realiza pasando el pretubo, con un mandril insertado, entre dos cilindros que giran en sentido contrario y que tienen un movimiento de vaivén en sentido longitudinal.
- Trefilado en frío, que estira el tubo y reduce su diámetro hasta las diferentes especificaciones comerciales. Se realiza en una máquina llamada "Bull Block" en la que el tubo es obligado a pasar a través de varias matrices externas y de un calibre interno llamado "mandril flotante".
- Recocido, tratamiento térmico que recristaliza el cobre y le permite recuperar la plasticidad perdida a lo largo de las operaciones anteriores.
- Acabado. Al tubo recocido se le pueden aplicar diversos tipos de acabado en función de la aplicación, por ejemplo un revestimiento externo de protección o un acabado interno muy liso.
- Control de calidad. Una prueba utilizada frecuentemente para detectar imperfecciones en tubos de cobre es la de inducción electromagnética por corrientes de Foucault.
- Embalaje, que varía según el tipo de tubo. Mientras que los recocidos o los de temple blando necesitan embalajes que los protejan de deformaciones durante el transport, los tubos laminados en frío de temple duro se empaquetan simplemente en atados. No es precisa protección de los agentes atmosféricos.[93]
Laminación
Una de las propiedades fundamentales del cobre es su maleabilidad que permite producir todo tipo de láminas desde grosores muy pequeños, tanto en forma de rollo continuo como en planchas de diversas dimensiones, mediante las instalaciones de laminación adecuadas.
Fundición de piezas
El cobre puro no es muy adecuado para fundición por moldeo porque produce galleo. Este fenómeno consiste en que el oxígeno del aire se absorbe sobre el cobre a altas temperaturas y forma burbujas; cuando después se enfría el metal, se libera el oxígeno de las burbujas y quedan huecos microscópicos sobre la superficie de las piezas fundidas.[94]
Sus aleaciones sí permiten fabricar piezas por cualquiera de los procesos de fundición de piezas que existen dependiendo del tipo de pieza y de la cantidad que se tenga que producir. Los métodos más usuales de fundición son por moldeo y por centrifugado.
Se denomina fundición por moldeo al proceso de fabricación de piezas, comúnmente metálicas pero también de plástico, consistente en fundir un material e introducirlo en una cavidad, llamada molde, donde se solidifica. El proceso tradicional es la fundición en arena, por ser ésta un material refractario muy abundante en la naturaleza y que, mezclada con arcilla, adquiere cohesión y moldeabilidad sin perder la permeabilidad que posibilita evacuar los gases del molde al tiempo que se vierte el metal fundido
El proceso de fundición centrifugada consiste en depositar una capa de fundición líquida en un molde de revolución girando a gran velocidad y solidificar rápidamente el metal mediante un enfriamiento continuo del molde o coquilla. Las aplicaciones de este tipo de fundición son muy variadas.
Forjado

El forjado en caliente de una pieza consiste en insertar en un molde una barra de metal, calentarla a la temperatura adecuada y obligarla a deformarse plásticamente hasta adoptar la forma del molde. La ventaja de forjar en caliente es que se reduce la potencia mecánica que debe suministrar la prensa para la deformación plástica.[95]
Los productos del cobre y sus aleaciones reúnen muy buenas condiciones para producir piezas por procesos de estampación en caliente, permitiendo el diseño de piezas sumamente complejas gracias a la gran ductilidad del material y la escasa resistencia a la deformación que opone, proporcionando así una vida larga a las matrices. Una aleación de cobre es “forjable” en caliente si existe un rango de temperaturas suficientemente amplio en el que la ductilidad y la resistencia a la deformación sean aceptables. Este rango de temperaturas depende de composición química que tenga, en la que influyen los elementos añadidos y de las impurezas.
Mecanizado

Las piezas de cobre o de sus aleaciones que van a someterse a trabajos de mecanizado por arranque de viruta tienen en su composición química una pequeña aportación de plomo y azufre que provoca una fractura mejor de la viruta cortada.
Actualmente (2008) el mecanizado de componentes de cobre, se realiza bajo el concepto de mecanizado rápido en seco con la herramienta refrigerada por aire si es necesario. Este tipo de mecanizado rápido se caracteriza porque los cabezales de las máquinas giran a velocidades muy altas consiguiendo grandes velocidades de corte en herramientas de poco diámetro.
Asimismo, las herramientas que se utilizan suelen ser integrales de metal duro, con recubrimientos especiales que posibilitan trabajar con avances de corte muy elevados. Los recubrimientos y materiales de estas herramientas son muy resistentes al desgaste, pueden trabajar a temperaturas elevadas, de ahí que no sea necesario muchas veces su refrigeración, tienen un coeficiente de fricción muy bajo y consiguen acabados superficiales muy finos y precisos.[96]
Soldadura

Para soldar uniones de cobre o de sus aleaciones se utilizan dos tipos de soldadura diferentes: soldadura blanda y soldadura fuerte.
La soldadura blanda es aquella que se realiza a una temperatura de unos 200 °C y se utiliza para la unión de los componentes de circuitos impresos y electrónicos. Se utilizan soldadores de estaño y el material de aporte es una aleación de estaño y plomo en forma de alambre en rollo y que tiene resina desoxidante en su alma. Es una soldadura poco resistente y sirve para asegurar la continuidad de la corriente eléctrica a través del circuito.[97]
Las soldaduras de tuberías de agua y gas realizadas por los fontaneros son de diversos tipos en función de los materiales que se quieran unir y de la estanqueidad que se quiera conseguir de la soldadura. Actualmente, la mayoría de los tubos de instalaciones de fontanería son de cobre, aunque en ocasiones se usan también otros materiales.
La soldadura de tuberías de cobre se realiza con sopletes de gas que proporcionan la llama para fundir el material soldante. El combustible del soplete puede ser butano o propano.
El cobre se utiliza también como aglutinante en la soldadura fuerte de fontanería, utilizada para conducciones de gas y canalizaciones complejas de agua caliente. Un metal alternativo para esta aplicación es la plata.[98]
Calderería

Se llama calderería a una especialidad profesional de la rama de fabricación metálica que tiene como función principal la construcción de depósitos aptos para el almacenaje y transporte de sólidos en forma de granos o áridos, líquidos y gas así como todo tipo de construcción naval y estructuras metálicas. Gracias a la excelente conductividad térmica que tiene la chapa de cobre se utiliza para fabricar alambiques, calderas, serpentines, cubiertas, etc.
Embutición
Se denomina embutición al proceso de conformado en frío por el que se transforma un disco o piezas recortada, según el material, en piezas huecas, e incluso partiendo de piezas previamente embutidas, estirarlas a una sección menor con mayor altura.
El objetivo es conseguir una pieza hueca de acuerdo con la forma definida por la matriz de embutición que se utilice, mediante la presión ejercida por la prensa. La matriz de embutición también es conocida como molde.
Se trata de un proceso de conformado de chapa por deformación plástica en el curso del cual la chapa sufre simultáneamente transformaciones por estirado y por recalcado produciéndose variaciones en su espesor. Para la embutición se emplean, casi exclusivamente, prensas hidráulicas.[99]
La chapa de cobre y sus aleaciones tienen unas propiedades muy buenas para ser conformados en frío. La embutición es un buen proceso para la fabricación en chapa fina de piezas con superficies complejas y altas exigencias dimensionales, sustituyendo con éxito a piezas tradicionalmente fabricadas por fundición y mecanizado.[100]
Estampación
Se conoce con el nombre de estampación a la operación mecánica que se realiza para grabar un dibujo o una leyenda en la superficie plana de una pieza que generalmente es de chapa metálica. Las chapas de cobre y sus aleaciones reúnen condiciones muy buenas para realizar en ellas todo tipo de grabados.
Los elementos claves de la estampación lo constituyen una prensa que puede ser mecánica, neumática o hidráulica; de tamaño, forma y potencia muy variada, y una matriz llamada estampa o troquel, donde está grabado el dibujo que se desea acuñar en la chapa, y que al dar un golpe seco sobre la misma queda grabado.
El estampado de los metales se realiza por presión o impacto, donde la chapa se adapta a la forma del molde. La estampación es una de las tareas de mecanizado más fáciles que existen, y permite un gran nivel de automatismo del proceso cuando se trata de realizar grandes cantidades de piezas.
La estampación se puede realizar en frío o en caliente, la estampación de piezas en caliente se llama forja, y tiene un funcionamiento diferente a la estampación en frío que se realiza en chapas generalmente. Las chapas de acero, aluminio, plata, latón y oro son las más adecuadas para la estampación. Una de las tareas de estampación más conocidas es la que realiza el estampado de las caras de las monedas en el proceso de acuñación de las mismas.
Troquelado

Se denomina troquelado a la operación mecánica que se realiza para producir piezas de chapa metálica o donde sea necesario realizar diversos agujeros en las mismas. Para realizar esta tarea, se utilizan desde simples mecanismos de accionamiento manual hasta sofisticadas prensas mecánicas de gran potencia.
Los elementos básicos de una prensa troqueladora lo constituyen el troquel que tiene la forma y dimensiones exteriores de la pieza o de los agujeros que se quieran realizar, y la matriz de corte por donde se inserta el troquel cuando es impulsado de forma enérgica por la potencia que le proporciona la prensa mediante un accionamiento de excéntrica que tiene y que proporciona un golpe seco y contundente sobre la chapa, produciendo un corte limpio de la misma.
Según el trabajo que se tenga que realizar, así son diseñadas y construidas las prensas. Hay matrices simples y progresivas donde la chapa, que está en forma de grandes rollos, avanza automáticamente provocando el trabajo de forma continuado, y no requiriendo otros cuidados que cambiar de rollo de chapa cuando se termina e ir retirando las piezas troqueladas así como vigilar la calidad del corte que realizan.
Cuando el corte se deteriora por desgaste del troquel y de la matriz, se desmontan de la máquina y se les rectifica en una rectificadora plana, estableciendo un nuevo corte. Una matriz y un troquel permiten muchos reafilados hasta que se desgastan totalmente.
Hay troqueladoras que funcionan con un cabezal donde puede llevar insertado varios troqueles de diferentes medidas y una mesa amplia donde se coloca la chapa que se quiere mecanizar. Esta mesa es activada mediante CNC y se desplaza a lo largo y ancho de la misma a gran velocidad, produciendo las piezas con rapidez y exactitud.
Toxicidad del cobre
Los mecanismos subyacentes a los efectos de intoxicación por Cu en humanos no son muy comprendidos. El Cu es un metal de transición que, al igual que el resto de este tipo de metales (excepto el Zn), tiene electrones desapareados en sus orbitales externos. Por este motivo es que estos metales pueden ser considerados radicales libres.[101]
Exposición humana
El cobre puede ser encontrado en muchas clases de comidas, en el agua potable y en el aire. Debido a que absorbemos una cantidad eminente de cobre cada día por la comida, bebiendo y respirando. La absorción del cobre es necesaria, porque el cobre es un elemento traza que es esencial para la salud de los humanos. Aunque los humanos pueden manejar concentraciones de cobre proporcionalmente altas, mucho cobre puede también causar problemas de salud.
Las concentraciones del cobre en el aire son usualmente bastante bajas, así que la exposición al cobre por respiración es insignificante. Pero gente que vive cerca de fundiciones que procesan el mineral cobre en metal pueden experimentar esta clase de exposición.
La gente que vive en casas que todavía tiene tuberías de cobre están expuestas a más altos niveles de cobre que la mayoría de la gente, porque el cobre es liberado en sus aguas a través de la corrosión de las tuberías.[102]
Exposición ambiental
Cada vez más y más cobre termina en el medio ambiente. Los ríos están depositando barro en sus orillas que están contaminados con cobre, debido al vertido de aguas residuales contaminadas con cobre. El cobre entra en el aire, mayoritariamente a través de la liberación durante la combustión de fuel. El cobre en el aire permanecerá por un periodo de tiempo eminente, antes de depositarse cuando empieza a llover. Este terminará mayormente en los suelos, como resultado los suelos pueden también contener grandes cantidades de cobre después de que esté sea depositado desde el aire.
El cobre puede ser liberado en el medio ambiente tanto por actividades humanas como por procesos naturales. Ejemplo de fuentes naturales son las tormentas de polvo, descomposición de la vegetación, incendios forestales y aerosoles marinos. El cobre es a menudo encontrado cerca de minas, asentamientos industriales, vertederos y lugares de residuos.
Cuando el cobre termina en el suelo este es fuertemente atado a la materia orgánica y minerales.
El cobre no se rompe en el ambiente y por eso se puede acumular en plantas y animales cuando este es encontrado en suelos. En suelos ricos en cobre sólo un número pequeño de plantas pueden vivir. El cobre puede seriamente influir en el proceso de ciertas tierras agrícolas, dependiendo de la acidez del suelo y la presencia de materia orgánica. A pesar de esto el estiércol que contiene cobre es todavía usado.
El cobre puede interrumpir la actividad en el suelo, su influencia negativa en la actividad de microorganismos y lombrices de tierra. La descomposición de la materia orgánica puede disminuir debido a esto.
Cuando los suelos de las granjas están contaminados con cobre, los animales pueden absorber concentraciones de cobre que dañan su salud. Principalmente las ovejas sufren un gran efecto por envenenamiento con cobre, debido a que los efectos del cobre se manifiestan a bajas concentraciones.[102]
Toxicidad aguda
A pesar de que en los trabajos químicos de referencia se indica que las sales de cobre son tóxicas, en la práctica esto sólo es cierto cuando las disoluciones se utilizan de forma incontrolada, con fines suicidas o como tratamiento tópico de áreas con quemaduras graves. Cuando se ingiere sulfato de cobre, también conocido como piedra azul o azul vitriolo, en cantidades del orden de gramos, se producen náuseas, vómitos, diarrea, sudoración, hemólisis intravascular y posible fallo renal; en raras ocasiones, se observan también convulsiones, coma y la muerte. Cuando se beben aguas carbonatadas o zumos de cítricos que han estado en contacto con recipientes, cañerías, grifos o válvulas de cobre se puede producir irritación del tracto gastrointestinal, que pocas veces llega a ser grave. Este tipo de bebidas son suficientemente ácidas para disolver niveles de cobre irritantes. Existe un informe de úlceras corneales e irritación cutánea, con baja toxicidad de otro tipo, en un minero de cobre que cayó en un baño electrolítico, aunque la causa pudo haber sido la acidez más que el cobre. En algunos casos en que se utilizaron sales de cobre para el tratamiento de quemaduras, se observaron concentraciones elevadas de cobre sérico y manifestaciones tóxicas. La inhalación de polvos, humos o nieblas de sales de cobre puede causar congestión nasal y de las mucosas, y ulceración con perforación del tabique nasal. Los humos desprendidos durante el calentamiento del cobre metálico pueden producir fiebre, náuseas, gastralgias y diarrea.[103]
Toxicidad crónica
Efectos tóxicos crónicos atribuibles al cobre sólo parecen existir en personas que han heredado una pareja específica de genes recesivos autosómicos y que, como consecuencia, desarrollan una degeneración hepatolenticular (enfermedad de Wilson). Es una enfermedad rara. La mayor parte de la alimentación diaria que consume el hombre contiene de 2 a 5 mg de cobre, que prácticamente no se retiene en el organismo.
El contenido corporal de cobre en una persona adulta es de 100 a 150 mg y es casi constante. En individuos normales (sin enfermedad de Wilson), casi todo el cobre está presente como parte integrante y funcional de una docena de proteínas y sistemas enzimáticos, como la citocromo oxidasa, la dopa-oxidasa y la ceruloplasmina sérica.
En personas que ingieren grandes cantidades de ostras o mariscos de concha, hígado, setas, nueces y chocolate, alimentos todos ellos ricos en cobre, o en mineros que trabajan y comen durante 20 años o más en un ambiente cargado con un 1 o 2 % de polvo de minerales de cobre, pueden llegar a observarse concentraciones hasta 10 veces superiores a lo normal.
Sin embargo, aún no se ha descrito ningún caso de toxicidad crónica primaria por cobre (perfectamente definida a partir de las observaciones de pacientes con toxicosis por cobre crónica heredada "la enfermedad de Wilson" como disfunción y lesiones estructurales hepáticas, del sistema nervioso central, de los riñones, los huesos y los ojos) excepto en personas que padecen la enfermedad de Wilson. Sin embargo, los depósitos excesivos de cobre hallados en el hígado de pacientes con cirrosis biliar primaria, colestasis y cirrosis infantil de la India pueden contribuir a la gravedad de la enfermedad hepática característica de estos procesos.[104]
Mecanismos de toxicosis
Los mecanismos subyacentes a los efectos de intoxicación por Cu en humanos no son muy comprendidos. El Cu es un metal de transición que, al igual que el resto de este tipo de metales (excepto el Zn), tiene electrones desapareados en sus orbitales externos. Por este motivo es que estos metales pueden ser considerados radicales libres. El Cu, al igual que el hierro puede participar en las reacciones tipo Fenton (1) y Häber-Weiss (2) produciendo ROS:
- Cu+ + H2O2 → Cu2+ + OH• + OH-
- Cu2+ + O2-• → Cu+ + O2
Las sales de Cu+ reaccionan con el H2O2 con mayor eficiencia que el Fe2+. De modo que el principal mecanismo de toxicosis mediada por cobre puede descansar en su habilidad para provocar sobreproducción de ROS y subsecuente daño pro-oxidativo a lípidos, ácidos nucleicos y proteínas
El cobre tiene importantes efectos como agente citotóxico y genotóxico desarrollando un papel importante en la etiopatogénesis de las neoplasias . Este último mecanismo consiste en dañar la estructura molecular del ADN por vía indirecta (ROS) o directamente por formación de complejos con grupos funcionales de las bases nitrogenadas que las modifican introduciendo mutaciones, o dificultando el proceso de reparación.
Se cree que una de las vías por las que los iones Cu ejercen su efecto tóxico es produciendo un aumento del estrés oxidativo en múltiples tejidos del organismo.[101]
Reciclado
El cobre es uno de los pocos materiales que no se degradan ni pierden sus propiedades químicas o físicas en el proceso de reciclaje.[41] Puede ser reciclado un número ilimitado de veces sin perder sus propiedades, siendo imposible distinguir si un objeto de cobre está hecho de fuentes primarias o recicladas. Esto hace que el cobre haya sido, desde la Antigüedad, uno de los materiales más reciclados.[10]
El reciclado proporciona una parte fundamental de las necesidades totales de cobre metálico. Se estima que en 2004 el 9 % de la demanda mundial se satisfizo mediante el reciclado de objetos viejos de cobre. Si también se considera "reciclaje" el refundido de los desechos del proceso de refinado del mineral, el porcentaje de cobre reciclado asciende al 34 % en el mundo y hasta un 41 % en la Unión Europea.[10]
El reciclado del cobre no requiere tanta energía como su extracción minera. A pesar de que el reciclado requiere recoger, clasificar y fundir los objetos de metal, la cantidad de energía necesaria para reciclar el cobre es solo alrededor de un 25 % de la requerida para convertir el mineral de cobre en metal.[105]
La eficacia del sistema de reciclado depende de factores tecnológicos como el diseño de los productos, económicos como el precio del cobre y sociales como el concienciamiento de la población acerca del desarrollo sostenible. Otro factor clave es la legislación. Actualmente existen más de 140 leyes, regulaciones, directivas y guías nacionales e internacionales que tratan de favorecer la gestión responsable del final del ciclo de vida de los productos que contienen cobre como por ejemplo electrodomésticos, teléfonos y vehículos.[41]
En la Unión Europea, la directiva 2002/96/CE sobre residuos de aparatos eléctricos y electrónicos (RAEE, o WEEE del inglés Waste Electrical and Electronic Equipment) propicia una política de minimización de desperdicios, que incluye una obligatoria y drástica reducción de los desechos industriales y domiciliarios, e incentivos para los productores que producen menos residuos.[106] El objetivo de esta iniciativa era reciclar 4 kilos por habitante al año a fines de 2006.
Un ejemplo de reciclaje masivo de cobre lo constituyó la sustitución de las monedas nacionales de doce países europeos por el euro en 2002, el cambio monetario más grande de la historia. Se eliminaron de la circulación unas 260.000 toneladas de monedas, conteniendo aproximadamente 147.496 toneladas de cobre, que fueron fundidas y recicladas para su uso en una amplia gama de productos, desde nuevas monedas hasta diferentes productos industriales.[105]
Producción y comercio
Producción minera
.svg.png)
La producción mundial de cobre durante el 2019 alcanzó un total de 20 millones de toneladas métricas de cobre fino.[108] El principal país productor es Chile, con casi un tercio del total, seguido por Perú y China:
| |||||||||||||||||||||||||||||||||
De entre las diez mayores minas de cobre del mundo, tres se encuentran en Chile (Escondida, Codelco Norte, Collahuasi, El Teniente y Los Pelambres), dos en Indonesia, una en Estados Unidos, una en Rusia y otra en Perú (Antamina, Toquepala, Cuajone, Cerro verde ).[41]
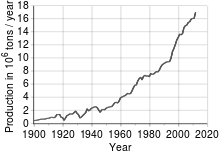
|
Reservas
De acuerdo a información entregada en el informe anual del United States Geological Survey (USGS), las estimaciones señalan que las reservas conocidas de cobre en el 2011 a nivel mundial alcanzarían 690 millones de toneladas métricas de cobre fino. Y según las estimaciones de USGS, en Chile existirían del orden de 190 millones de toneladas económicamente explotables, equivalentes al 28 % del total de reservas mundiales del mineral; seguido de Perú con 90 millones de toneladas económicamente explotables, equivalentes al 13 % del total de reservas mundiales del mineral:[111]
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Comercio y consumo
El cobre es el tercer metal más utilizado en el mundo, por detrás del hierro y el aluminio.[112] Existe un importante comercio mundial de cobre que mueve unos 30 000 millones de dólares anuales.[113]
Los tres principales mercados de cobre son el LME de Londres, el COMEX de Nueva York y la Bolsa de Metales de Shanghái. Estos mercados fijan diariamente el precio del cobre y de los contratos de futuros sobre el metal.[113] El precio de suele expresar en dólares / libra y en la última década ha oscilado entre los 0,65 $/lb de finales de 2001 y los más de 4,00 $/lb alcanzados en 2006 y en 2008.[114] El fuerte encarecimiento del cobre desde 2004, debido principalmente al aumento de la demanda de China y otras economías emergentes,[115] ha provocado una oleada de robos de objetos de cobre (sobre todo cables) en todo el mundo, con los consiguientes riesgos para la infraestructura eléctrica.[116][117][118][119]
| Rango | Estado | Consumo de cobre refinado ( en mill. ton/año ) |
|---|---|---|
| 1 | Unión Europea | 4,32 |
| 2 | China | 3,67 |
| 3 | Estados Unidos | 2,13 |
| 4 | Japón | 1,28 |
| 5 | Corea del Sur | 0,81 |
| 6 | Rusia | 0,68 |
| 7 | Taiwán | 0,64 |
| 8 | India | 0,44 |
| 9 | Brasil | 0,34 |
| 10 | México | 0,30 |
Fuente: World Copper Factbook 2007[41]
Los principales productores de mineral de cobre son también los principales exportadores, tanto de mineral como de cobre refinado y derivados. Los principales importadores son los países industrializados: Japón, China, India, Corea del Sur y Alemania para el mineral y Estados Unidos, Alemania, China, Italia y Taiwán para el refinado.[41]
Evolución del precio del cobre
centávos de dolar por libra de cobre (noviembre 2008=100)
Fuente: Sociedad Nacional Minera de Chile[120]
Véase también
- Acero galvanizado
- Calco (moneda)
- Cobrero
- Conductividad eléctrica
- Elemento químico esencial
- Grupo Internacional de Estudio sobre el Cobre
- Hipocupremia
- Iridio
- Metal de transición
- New York Mercantile Exchange
- Oro
- Plata
- Platino
- Soldadura
- Tubería
Notas y referencias
- «Size of copper in several enviroments» (en inglés). WebElements.com.
- «Copper annealed». matweb. Consultado el 2 de mayo de 2008.
- Propiedades físicas del cobre (en inglés), en WebElements.com
- Cobre: entalpías y propiedades termodinámicas (en inglés), en WebElements.com
- Joan Corominas: Breve diccionario etimológico de la lengua castellana. 3º edición, 1987. Ed. Gredos, Madrid.
- Varios autores (1984). Enciclopedia de Ciencia y Técnica. Tomo 4 Cobre. Salvat Editores. ISBN 84-345-4490-3.
- Enfermedad de Wilson Medline Plus. Enciclopedia Médica [3 de abril de 2008]
- Informes sobre producción mundial de cobre refinado Archivado el 10 de diciembre de 2008 en la Wayback Machine. Cochilco Chile [30 de abril de 2008]
- Robb, Laurence, ed. (2007). Introduction to Ore-Forming Processes (en inglés) (cuarta edición). Berlin, Stuttgart: Blackwell Science Ltd. pp. 106. ISBN 0-632-06378-5. (requiere registro).
- Les atouts du cuivre pour construire un avenir durable Archivado el 23 de mayo de 2012 en la Wayback Machine., en el sitio de EuroCopper (en francés). Consultada el 20 de abril de 2008.
- Simbolismo químico, en Enseñanza de la Física y la Química. Grupo Heurema. Educación Secundaria. Consultado el 21 de abril de 2008.
- Symbol 41a:7 (en inglés) en Symbols.com Archivado el 22 de agosto de 2017 en la Wayback Machine.. Consultado el 21 de abril de 2008.
- About the Ankh Cross Archivado el 14 de marzo de 2011 en la Wayback Machine., en holoweb.net. Consultado el 21 de abril de 2008.
- ANDREWS, Michael (1992). El nacimiento de Europa. Planeta/RTVE. ISBN 84-320-5955-2. Capítulo 3.
- Armengot, Joaquín et al (septiembre de 2006), Orígenes y desarrollo de la minería Archivado el 3 de marzo de 2016 en la Wayback Machine., en Industria y Minería, n.º 365, Departamento de Ingeniería Geológica, E. T. S. de Ingenieros de Minas de Madrid, Universidad Politécnica de Madrid, España [29 de abril de 2008]
- Iceman. El hacha (en inglés), Museo Arqueológico de Tirol del Sur, Italia. [29 de abril de 2008]
- Lorenzi, Rosella (20 de marzo de 2002), Ötzi, the Iceman, (en inglés) en laughtergenealogy.com, Discovery News [29 de abril de 2008]
- University of Pennsylvania Museum of Archaeology and Anthropology (2008), The Ban Chiang Metals Project Database, (en inglés) [17 de mayo de 2008]
- University of Nevada (20 de mayo de 1997). «Copper: The Red Metal» (en inglés). Archivado desde el original el 15 de abril de 2008. Consultado el 22 de abril de 2008.
- Procobre Venezuela (2007), , en Historia del Cobre, Procobre. [17 de mayo de 2008]
- Sousa y Francisco, Antonio de (2004). «700 años de artillería». Archivado desde el original el 7 de junio de 2004. Consultado el 24 de abril de 2008.
- Procobre Peú (2007), Edad Moderna, en Historia del cobre, Procobre
- Nadia Fdez de Pinedo Echevarría (2005) Minería y desarrollo empresarial en España
- López Valverde, Rafael (2005), Historia del electromagnetismo, Junta de Andalucía, España [17 de mayo de 2008]
- Copper in the USA, en Copper.org
- U.S. Geological Survey; Kelly T.D. y Matos, G.R. (enero de 2008). «Copper Statistics». Historical statistics for mineral and material commodities in the United States (en inglés). Archivado desde el original el 11 de mayo de 2008. Consultado el 6 de abril de 2008.
- Codelco Chile (2006), Historia de Codelco, URL accedida el 24 de mayo de 2008.
- Ministerio de Minería (25 de enero de 1966). «Ley 16425 de 1966» (HTML). Consultado el 5 de abril de 2011.
- Ministerio de Minería (15 de mayo de 1967). «Ley 16624 de 1967» (HTML). Consultado el 3 de abril de 2011.
- Ministerio de Minería (16 de julio de 1971). «Ley 17450 de 1971» (HTML). Consultado el 9 de marzo de 2011.
- La tradición de Chuquicamata en Chile, Univisión (2 de octubre de 2006). Consultado el 1 de junio de 2008
- División Codelco Norte, Codelco. Consultado el 1 de junio de 2008.
- Chuquicamat 92 años (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última)., Codelco. Consultado el 1 de junio de 2008.
- Codelco (s/f). «Operaciones - Chuquicamata» (HTML). www.codelco.com. Consultado el 22 de noviembre de 2011.
- Chuquicamata celebra por última vez, La Nación (14 de mayo de 2007), Chile. Consultado el 1 de junio de 2008.
- RSC.- 'Minera Escondida' paraliza sus trabajos por la huelga de casi 2.000 trabajadores que piden mejoras laborales, El Ecomonista (18 de agosto de 2006). Consultado el 1 de junio de 2008
- Concluye la huelga del cobre en Chile después de 25 días, El periódico de México (1 de setiembre de 2001). Consultado el 1 de junio de 2008.
- Resultados Enero-Diciembre de 2007 (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última)., Minera Escondida (5 de febrero de 2008). Consultado el 1 de junio de 2008.
- Copper. 2007, en Mineral Commodity Summaries, Servicio Geológico de Estados Unidos.
- Toovey, Leia Michele (17 de noviembre de 2010). de octubre de copper-producing-countries/ «The Top 10 Copper Producing Countries» (en inglés). copperinvestingnews.com. Consultado el 18 de abril de 2012.
- International Copper Study Group (2007), The World Copper Factbook 2007 (en inglés)
- Marques, Miguel (2001), Isótopos del cobre Archivado el 30 de abril de 2007 en la Wayback Machine., (en portugués) en nautilus.fis.uc.pt. [2 de mayo de 2008]
- «Norma ASTM E1004-02» (en inglés). ASTM. 2002. Archivado desde el original el 18 de mayo de 2008. Consultado el 4 de mayo de 2008.
- «Appendix 4 - Types of Copper». Megabytes on Copper (en inglés). Copper Development Association. 2006. Archivado desde el original el 7 de diciembre de 2007.
- Cu (Cobre y compuestos) (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última)., Registro Estatal de Emisiones y Fuentes Contaminantes (2008). Consultado el 24 de mayo de 2008.
- Compuestos Complejos, en alipso.com [2 de mayo de 2008]
- Cobre y sus aleaciones Archivado el 9 de diciembre de 2012 en la Wayback Machine., Observatorio Tecnológico de la Soldadura, España. Consultado el 24 de mayo de 2008
- CENIM (2002), Efectos de la contaminación atmosférica en la conservación del Patrimonio Histórico, Red Temática de Patrimonio Histórico Cultural, Centro Nacional de Investigaciones Metalúrgicas, España
- Cobre, Denarios (2004). Consultado el 24 de mayo de 2008
- Cobre, en IPNS - Glosario de la gestión integrada de los nutrientes, FAO (2007). Consultado el 27 de mayo de 2008.
- Klevay, Leslie M.; Collins, James F. (1 de noviembre de 2011). «Copper». Advances in Nutrition (en inglés) 2 (6): 520-522. ISSN 2161-8313. doi:10.3945/an.111.001222. Consultado el 20 de marzo de 2019.
- Cobre, en Medlineplus. Consultado el 27 de mayo de 2008.
- Cobre, Agencia para Sustancias Tóxicas y el Registro de Enfermedades. Departamento de Salud y Servicios Humanos de Estados Unidos (2004). Consultado el 4 de junio de 2008.
- Valores de referencia de sustancias químicas cuya presencia en el agua de bebida es significativa para la salud, en Guías para la calidad del agua potable, 3ª ed., vol. 1: Recomendaciones. OMS (2004), Ginebra. [4 de junio de 2008]
- Estándares del Reglamento Nacional para Agua Potable de los Estados Unidos Archivado el 5 de septiembre de 2005 en la Wayback Machine., Agua Latinoamérica (2001). Consultado el 4 de junio de 2008
- Laboratorio de Química Ambiental de la Universidad Nacional del Nordeste (2006) Cobre, en Comunicaciones Científicas y Tecnológicas, Congreso Nacional de Química UNSL, Argentina. [4 de junio de 2008]
- Efectos del cobre sobre la salud. Lenntech [30 de abril de 2007]
- Fichas internacionales de seguridad química. Cobre N°CAS 7440-50-8 Archivado el 15 de junio de 2016 en la Wayback Machine. [30 de abril de 2007]
- Coca Cebollero, P. y Rosique Jiménez, J. (2000). Ciencia de Materiales. Teoría - ensayos- tratamientos. Ediciones Pirámide. ISBN 84-368-0404-X.
- Metal Alloy UNS Number Search (en inglés), Matweb
- Gandara Mario, Plata alemana, Biblioteca de Joyería Ybarra. [5 de abril de 2008]
- Alpaca, plata alemana y aleaciones relacionadas (en inglés) [7 de abril de 2008]
- Cobre y sus manufacturas, en Scavage
- P.Coca Rebollero y J. Rosique Jiménez (2000). Ciencia de Materiales Teoría- Ensayos- Tratamientos. Ediciones Pirámide. ISBN 84-368-0404-X.
- Gandara Mario Plata alemana Biblioteca de joyería[5 de abril de 2008]
- Vial, Cristián (2002), Cobre y sus aleaciones, Escuela de Ingeniería, Universidad Católica de Chile. [5 de abril de 2008]
- Copper Development Association. "Publication Number 82: Aluminium Bronze Alloys Technical Data". (en inglés) [8 de abril de 2008]
- Bronce al berilio Inglés. Copper.org[7 de abril de 2008]
- Aleaciones de cobre Archivado el 30 de marzo de 2008 en la Wayback Machine. codeleduca Chile. [4 de marzo de 2008]
- F. González, Adolfo et al (2004), Materiales eléctricos, Departamento de electrónica, Facultad Regional de Mendoza, Universidad Tecnológica Nacional, Argentina
- Obtención del cobre Cursos de metalurgia Chile [3 de mayo de 2004]
- Guevara, Jesús Obtención del cobre Monografías.com [3 de mayo de 2008]
- Arlandis Rubio, J. (1999), La Metalurgia del Cobre Archivado el 17 de febrero de 2007 en la Wayback Machine., en www.aim.es [30 de abril de 2007]
- Proceso de fundición del cobre Archivado el 3 de noviembre de 2007 en la Wayback Machine. Atlantic-copper.com [30 de abril de 2008]
- Gandara Barcelona, Mario (2006), Tratamientos térmicos de los metales, Biblioteca de joyería Ybarra [25 de abril de 2007]
- Coca Cebollero, P. y Rosique Jiménez, J. (2000). Ciencia de Materiales Teoría- ensayos- tratamientos. Ediciones Pirámide. ISBN 84-368-0404-X.
- Manual de fontanería Materiales y prácticas [30 de abril de 2007]
- «Monedas de euro». Banco Central Europeo. Archivado desde el original el 3 de enero de 2007. Consultado el 20 de abril de 2008.
- «Coin Specifications» (en inglés). The United States Mint. Consultado el 20 de abril de 2008.
- Catálogo de monedas europeas. Web consultada el 20 de abril de 2008.
- Usos del cobre, Idipedia [Consulta: 10 de julio de 2015]
- Sulfato de cobre en la web de Agrosagi [30 de abril de 2007]
- Cerámica árabe, Cerámica artística. Consultado el 3 de junio de 2008.
- La cerámica verde y manganeso de época omeya, Asociación Cultural Nueva Acrópolis en Córdoba, España. Consultado el 4 de junio de 2008.
- Diccionario de la cerámica de Sevilla Archivado el 4 de marzo de 2016 en la Wayback Machine. Azulejos al cobre [3 de junio de 2008]
- Breves anotaciones sobre la historia del Reflejo metálico en la cerámica artesana. Cerámicas Ur.
- Sancho, N.; Santos, S.; De La Roja, J. M.; San Andrés, M. (2004), Variación cromática del verdigrís en función de su método de obtención (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última)., en Óptica Pura y Aplicada, vol. 37, n.º 1, Facultad de Bellas Artes, Universidad Complutense de Madrid, España. Consultado el 3 de junio de 2008.
- Blister y ánodos de cobre Codelco.com Chile.[4 de marzo de 2008]
- Cátodos de cobre Atlantic-Copper. España [4 de marzo de 2008]
- Alambrón Atlantic-copper.es.España [5 de abril de 2008]
- Alambre de cobre desnudo Archivado el 28 de julio de 2007 en la Wayback Machine. Flexotek.com [5 de abril de 2000]
- Trefilado del cobre en la web de Coalco [5 de marzo de 2008]
- «El tubo de cobre». Procobre Perú. 2000. Archivado desde el original el 23 de abril de 2009.
- Galleo. Defecto de fundición Archivado el 13 de marzo de 2017 en la Wayback Machine. bencoins.com [6 de abril de 2008]
- Estampación en caliente. Artículo técnico Forbrass.com [6 de abril de 2008]
- Mecanizado rápido del cobre Archivado el 4 de marzo de 2016 en la Wayback Machine. Mitsubishi [5 de abril de 2008]
- La soldadura blanda Archivado el 7 de enero de 2017 en la Wayback Machine. Tutorial de soldadura. Dpto. de Ingeniería Eléctrica y Electrónica, Tecnológico de Monterrey [6 de abril de 2008]
- Manual de fontanería Soplete y soldadura. Mailxmail.com [6 de abril de 2008]
- Prensas hidráulicas Fluidica.com [6 de abril de 2008]
- Montalvo Soberón, Luis Alberto. «Proceso de embutido de chapas metálicas». Monografías.com. Consultado el 6 de abril de 2008.
- Nathalie Arnal. «Intoxicación por cobre. Efectos sobre la composición lipídica y el sistema de defensa antioxidante.». Archivado desde el original el 3 de marzo de 2016. Consultado el 19 de noviembre de 2015.
- «Cobre (Cu) Propiedades químicas y efectos sobre la salud y el medio ambiente». www.lenntech.es. Consultado el 19 de noviembre de 2015.
- Gunnar Nordberg. «METALES: PROPIEDADES QUIMICAS Y TOXICIDAD». Archivado desde el original el 24 de septiembre de 2015. Consultado el 19 de noviembre de 2015.
- Gunnar Nordberg. «METALES: PROPIEDADES QUIMICAS Y TOXICIDAD» (pdf). Archivado desde el original el 24 de septiembre de 2015. Consultado el 19 de noviembre de 2015.
- «Las naciones de la Eurozona están reciclando sus monedas nacionales». European Copper Institute. Archivado desde el original el 28 de septiembre de 2007. Consultado el 28 de mayo de 2008.
- Directiva 2002/96/CE del Parlamento Europeo y del Consejo, de 27 de enero de 2003, sobre residuos de aparatos eléctricos y electrónicos (RAEE), Diario Oficial de la Unión Europea L 37 (13/2/2003)
- World mineral production 2002-2006 (en inglés), British Geological Survey, Natural enviroment Research Council (2007), pp. 24-29.
- INews Copper
- «Ranking de las mayores minas de cobre a nivel mundial en 2018, por capacidad de producción (en miles de toneladas métricas)». Statista. 2018.
- «Tres minas peruanas entre las 10 operaciones cupríferas más grandes en el mundo». Miningpress. 10 de enero de 2019.
- "United States Geological Survey (USGS)"
- «NYMEX.com: Copper» (en inglés). Consultado el 3 de mayo de 2008.
- CODELCO. «Zona del Cobre».
- Gráfico del precio del cobre entre 2000 y 2008 en el Comex de Nueva York. Consultada el 4 de mayo de 2008.
- Las causas del alto precio del cobre, traducción de un artículo del Wall Street Journal de marzo de 2006. Web consultada el 4 de mayo de 2008.
- «El alto precio del cobre multiplica los robos de cable». Diario Sur, de Málaga (España). marzo de 2006. Consultado el 4 de mayo de 2008.
- «Urgente campaña vs robo de cobre». El Ágora, de Chihuahua (México). marzo de 2008. Archivado desde el original el 21 de agosto de 2014. Consultado el 4 de mayo de 2008.
- «Copper robbers hit building site». Oakland Tribune, de California (EE.UU.). julio de 2006. Consultado el 4 de mayo de 2008.
- «Robbers escape with five tonnes of copper». New Straits Times, de Malaca (Malaysia). mayo de 2008. Archivado desde el original el 19 de julio de 2018. Consultado el 4 de mayo de 2008.
- Sociedad Nacional Minera de Chile. «Precio Histórico del Cobre». SONAMI.
Bibliografía
- Varios autores (1984). Enciclopedia de Ciencia y Técnica. Tomo 4 Cobre. Salvat Editores. ISBN 84-345-4490-3.
- Andrews, Michael (1992). El nacimiento de Europa: Capítulo 3. Planeta/RTVE. ISBN 84-320-5955-2.
- Coca Cebollero, P. y Rosique Jiménez, J. (2000). Ciencia de Materiales. Teoría - ensayos- tratamientos. Ediciones Pirámide. ISBN 84-368-0404-X.
- Duque Jarmillo, Jaime et al (2007). Estructura cristalina del cobre, propiedades microscópicas mecánicas y de procesamiento. Ciencia e Ingeniería Neogranadina, vol. 16, n.º 2, ISSN=0124-8170.
- William F. Smith (1998). Fundamentos de la Ciencia e Ingeniería de Materiales. Madrid: Editorial Mc Graw Hill. ISBN 84-481-1429-9.
Enlaces externos
 Wikimedia Commons alberga una categoría multimedia sobre Cobre.
Wikimedia Commons alberga una categoría multimedia sobre Cobre.
 Wikcionario tiene definiciones y otra información sobre [[wikt::cobre|cobre]].
Wikcionario tiene definiciones y otra información sobre [[wikt::cobre|cobre]].- Cobre; en Enviromental Chemistry (en inglés).
- Cobre; en Jefferson Lab (en inglés)
- Cobre; en ATSDR en español - ToxFAQs™, Agencia de Sustancias Tóxicas y Registro de Enfermedades, Estados Unidos.
- Copper Development Association (en inglés).
- Codelco.
- Estadísticas sobre el cobre (producción, consumo y precios). Servicio Geológico de Estados Unidos (USGS) (en inglés).
- Cobre. Fichas Internacionales de Seguridad Química, Instituto Nacional de Seguridad e Higiene en el Trabajo, España.
- Torres P., J. C. (2005) Cobre, Medio Ambiente y Salud. Aportes de la Ciencia. Instituto de Innovación en Minería y Metalurgia, Chile.
- Cobre; en Dieta y nutrición, Instituto Químico Biológico, España.
- Cobre; en webElements.com (en inglés).
- Cobre; en EnvironmentalChemistry.com (en inglés).
- Los metales (1), El cobre; en YouTube. Vídeo sobre la historia del cobre.
- Centro Español de Información del Cobre.
- ProCobre Latinoamérica.
- Biolixiviación: técnica efectiva para la recuperación del cobre