Bromo
El bromo (también llamado antaño fuego líquido) es un elemento químico de número atómico 35 situado en el grupo de los halógenos (grupo VII A) de la tabla periódica de los elementos. Su símbolo es Br.[1][2]
| Selenio ← Bromo → Kriptón | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tabla completa • Tabla ampliada | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Gas o líquido: marrón rojizo Sólido: metálico lustroso | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Información general | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | Bromo, Br, 35 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie química | Halógenos | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 17, 4, p | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atómica | 79,904 u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [Ar]4s23d104p5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrones por nivel | 2, 8, 18, 7 (imagen) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio medio | 115 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividad | 2,96 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio atómico (calc) | 94 pm (radio de Bohr) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 114 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio de van der Waals | 185 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado(s) de oxidación | -1', +1, +3, +5, +7, | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Óxido | Ácido fuerte | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1.ª energía de ionización | 1139,9 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2.ª energía de ionización | 2103 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3.ª energía de ionización | 3470 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4.ª energía de ionización | 4560 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5.ª energía de ionización | 5760 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6.ª energía de ionización | 8550 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 7.ª energía de ionización | 9940 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 8.ª energía de ionización | 18600 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado ordinario | Líquido muy móvil y volátil | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad | (26,85 °C) 3119 kg/m3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusión | 265,8 K (−7 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullición | 332 K (59 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de vaporización | 15,438 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de fusión | 5,286 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Presión de vapor | 5800 Pa a 6,85 °C | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Varios | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | Ortorrómbica | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor específico | 480 J/(K·kg) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 0,122 W/(K·m) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidad del sonido | 206 m/s a 293,15 K (20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isótopos más estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Isótopos del bromo | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Valores en el SI y condiciones normales de presión y temperatura, salvo que se indique lo contrario. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El bromo a temperatura ambiente es un líquido rojo, volátil y denso. Su reactividad es intermedia entre el cloro y el yodo. En estado líquido es peligroso para el tejido humano y sus vapores.
Historia

El bromo (del griego bromos, que significa "hedor" o pestilencia) fue descubierto en 1826 por Antoine-Jérôme Balard, pero no se produjo en cantidades importantes hasta 1860.
Abundancia y obtención
La mayor parte del bromo se encuentra en el mar en forma de bromuro, Br-. En el mar presenta una concentración de unos 65 µg/g.
El bromo molecular, Br2 se obtiene a partir de las salmueras, mediante la oxidación del bromuro con cloro, una vez obtenido este:
- 2Br - + Cl2 → Br2 + 2Cl-
Es necesario emplear un proceso de destilación para separarlo del Cl2.
Aproximadamente se producen en el mundo 500 millones de kilogramos de bromo por año (2001). Estados Unidos e Israel son los principales productores. Las aguas del mar Muerto y las minas de Stassfurt son ricas en bromuro de potasio.
Compuestos
Puede presentar distintos estados de oxidación. Los más comunes son -1 (lo más común), +1 (con cloro) +3 (con flúor) y +5 (con oxígeno).
- El estado de oxidación +1 es poco estable, pero muy oxidante desde el punto de vista cinético, en disolución acuosa y desproporciona a los estados de oxidación -1 y +5. Por ejemplo, el ion hipobromito, BrO- (sólo estable a bajas temperaturas 0 °C).
- El estado de oxidación +3 es poco estable en disolución acuosa y desproporciona a los estados de oxidación +1 y +5. Por ejemplo, el ion bromito, BrO2-, o el ácido bromoso, HBrO2 (muy inestable).
- El estado de oxidación +5 es termodinámicamente estable frente a la desproporción en disolución acuosa. Por ejemplo, el ion bromato, BrO3-. El bromato es un oxidante fuerte (como el permanganato) más oxidante que el clorato y cinéticamente más reactivo. Es además un carcinógeno (sospechas muy fuertes).
- El ion perbromato, BrO4-, con un estado de oxidación +7, se reduce con relativa facilidad y se prepara con dificultad: empleando flúor elemental o por métodos electrolíticos, es un oxidante muy fuerte 1,8 aunque algo lento desde el punto cinético.
El BrO3F (fluoruro de perbromilo) es un agente nuevo mucho más inestable que el análogo clorado y tan reactivo que destruye hasta el teflón. Es también un ácido de Lewis al contrario de su homólogo clorado fluoruro de perclorilo, formando un complejo BrO3F2(-1) análogo al XeO3F2. Cuando reacciona con ácidos de Lewis el bromo se reduce a +5 desprendiendo oxígeno, el análogo clorado no reacciona con pentafluoruro de antimonio SbF5.
- El bromo también forma compuestos con otros halógenos (interhalógenos). Por ejemplo, BrF5, BrF3, IBr, etc.
El BrF5, es un líquido que reacciona explosivamente con casi todas las sustancias muy similar en reactividad al ClF3 capaz de hacer arder a las sustancias utilizadas como extintores, el agua, vidrio, óxidos, haluros y una amplia variedad de sustancias inorgánicas reaccionan, las sustancias orgánicas reaccionan explosivamente.
- Hay muchos compuestos en los que el bromo presenta estado de oxidación -1, llamándose a estos bromuros.
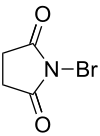
Se pueden obtener fácilmente compuestos orgánicos bromados, por ejemplo, mediante bromación radicalaria con bromo molecular y en presencia de luz o empleando N-bromosuccinimida, o bien por reacciones de adición o de sustitución. El compuesto orgánico bromuro de metilo, CH3Br, se emplea como plaguicida, pero afecta a la capa de ozono. Se ha determinado que los átomos de bromo son más eficaces que los de cloro en los mecanismos de destrucción de la capa de ozono, sin embargo los átomos de bromo están en menor cantidad.
El bromuro de hidrógeno, HBr, se obtiene por reacción directa de bromo con hidrógeno molecular o como subproducto de procesos de bromación de compuestos orgánicos.A 400º ataca al vidrio.Es muy ácido. A partir de este, se pueden obtener distintos bromuros, por ejemplo:
- HBr + NaOH → NaBr + H2O
Es mucho más inestable que su análogo clorado y es reductor.
El ácido nítrico oxida a los bromuros en presencia de nitritos enérgicamente.
El bromo en disolución acuosa puede desproporcionar:
- Br2 + OH- → Br- + BrOH
Pero la reacción no transcurre en medio ácido.
También se puede obtener por oxidación el ion Br2+.
Papel biológico
El bromo se encuentra en niveles de trazas en humanos. Es considerado un elemento químico esencial, aunque no se conocen exactamente las funciones que realiza. Algunos de sus compuestos se han empleado en el tratamiento contra la epilepsia y como sedantes.
Isótopos
En la naturaleza se encuentran dos isótopos: 79Br y 81Br, los dos con una abundancia de cerca del 50%.
Aplicaciones
Las aplicaciones químicas e industriales del bromo son numerosas y variadas, destacando los compuestos organobromados, los cuales son preparados a partir de bromo diatómico o bien de bromuro de hidrógeno (ácido bromhídrico en disolución acuosa).
La prueba del bromo consiste en el uso de agua de bromo con el objetivo de detectar la presencia de compuestos orgánicos insaturados.
Los bromuros actúan médicamente como sedantes y el bromuro de plata se utiliza como un elemento fundamental en las placas fotográficas.
Precauciones
El bromo elemental es altamente tóxico y a partir pequeñas trazas (10 ppm), tanto por vía cutánea como respiratoria, puede causar problemas inmediatos de salud y en dosis mayores la muerte. Es muy irritante tanto para los ojos como para la garganta; en contacto con la piel produce quemaduras dolorosas. Un manejo inapropiado supone un serio riesgo para la salud, requiriendo máximas precauciones para su gestión segura.
Referencias
- Garritz, Andoni (1998). Química. Pearson Educación. p. 856. ISBN 978-9-68444-318-1.
- Parry, Robert W. (1973). Química: fundamentos experimentales. Reverte. p. 703. ISBN 978-8-42917-466-3.
Enlaces externos
 Wikimedia Commons alberga una galería multimedia sobre Bromo.
Wikimedia Commons alberga una galería multimedia sobre Bromo.- WebElements.com - Bromine
- EnvironmentalChemistry.com - Bromine
- Instituto Nacional de Seguridad e Higiene en el Trabajo de España: Ficha internacional de seguridad química del bromo.