No metal
Los no metales son elementos químicos que no son buenos conductores de la corriente eléctrica y el calor. Son muy débiles, por lo que no se pueden ni estirar ni convertir en una lámina.[1]
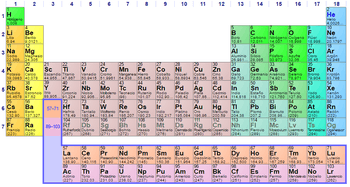
Las propiedades químicas de los no metales, a diferencia de los metales, son muy diversas, a pesar de que representan un número muy reducido, la mayoría de ellos son esenciales para los sistemas biológicos (oxígeno, carbono, hidrógeno, nitrógeno, fósforo y azufre). En el grupo de los no metales se incluyen los halógenos[1] (flúor, cloro, bromo, yodo, astato y téneso), que tienen 7 electrones en su última capa de valencia y los gases nobles (helio, neón, argón, kriptón, xenón, radón), que tienen 8 electrones en su última capa (excepto el helio, que tiene 2). Por lo tanto, dicha capa está completa y son poco reactivos. El resto de los no metales pertenecen a diversos grupos y son hidrógeno, carbono, azufre, selenio, nitrógeno, oxígeno y fósforo. Las propiedades únicas del hidrógeno lo apartan del resto de los elementos en la Tabla Periódica de Elementos.
Los no metales son los elementos situados a la derecha en la Tabla, por encima de la línea quebrada de los grupos 14 a 17 (incluido el hidrógeno).[2] Colocados en orden creciente de número atómico, los elementos pueden clasificarse por similitud de propiedades en 18 familias o grupos (verticalmente por columnas).
Desde el punto de vista de la electrónica, los elementos de una familia poseen la misma configuración electrónica en la última capa, aunque difieren en el número de capas (períodos).[3] Los grupos o familias son 18 y se corresponden con las columnas de la Tabla Periódica de Elementos.
Características
.jpg)
Los no metales varían mucho en su apariencia, no son lustrosos y por lo general son malos conductores del calor y la electricidad. Sus puntos de fusión son más bajos que los de los metales (aunque el diamante, una forma de carbono, funde a 3570 ºC).[4] Varios no metales existen en condiciones ordinarias como moléculas diatómicas.
En esta lista[5]están incluidos cinco gases (H2, N2, O2, F2 y Cl2), un líquido (Br2) y un sólido volátil (I2). El resto de los no metales son sólidos que pueden ser duros como el diamante o blandos como el azufre. Al contrario de los metales, son muy frágiles y no pueden estirarse ni en hilos ni en láminas.
Se encuentran en los tres estados de la materia a temperatura ambiente: son gases (como el oxígeno), líquidos (bromo) y sólidos (como el carbono). No tienen brillo metálico y no reflejan la luz. Muchos no metales se encuentran en todos los seres vivos: carbono, hidrógeno, oxígeno, nitrógeno, fósforo y azufre en cantidades importantes. Otros son oligoelementos: selenio, yodo, cloro.
Pueden ser sólidos, líquidos o gases, indistintamente. Sus puntos de fusión y ebullición dependen de sus propiedades químicas, que están relacionadas con su capacidad para ganar electrones (los de la última capa, o sea los de valencia).
No conducen bien la electricidad, muchos ante ella se descomponen o recombinan químicamente. Con el agua dan generalmente sustancias ácidas. Están ubicados a la derecha de la Tabla Periódica de Elementos, y al combinarse químicamente ganan electrones para adquirir la configuración electrónica del gas noble del mismo periodo.
Propiedades físicas:[6]
- Sólidos (Ej: azufre y carbono).
- Líquidos (únicamente el bromo).
- Gaseosos (Ej: oxígeno e hidrógeno).
- No poseen brillo metálico a excepción del yodo.
- No son dúctiles ni maleables.
- No son buenos conductores del calor y de la electricidad (a excepciones de algunas formas alotrópicas del carbono y el fósforo).
Propiedades químicas:
- Sus átomos tienen en su última capa 4, 5, 6 y/o 7 electrones.
- Al ionizarse adquieren carga negativa.[7]
- Al combinarse con el oxígeno forman óxidos no metálicos o anhídridos.
- Poseen moléculas formadas por dos o más átomos.
Reactividad, diferencia con los metales
Los no metales tienen tendencia a parecerse a los gases nobles más cercanos en cuanto a la configuración electrónica de su última capa. Los menos electronegativos tendrán tendencia a perder electrones frente a otros más electronegativos.
La reactividad de un elemento mide la tendencia a combinarse con otros.
- Variación de la reactividad en los grupos. Son más reactivos los grupos de la izquierda que los de la derecha dado que resulta más fácil perder un electrón de la última capa que dos, tres,... Cuando llegamos a cierto grupo la tendencia se invierte dado que resultará más fácil ganar los electrones que le faltan para parecerse al gas noble más cercano.[8] Por tanto, en un período.
- La reactividad de los metales aumenta cuanto más a la izquierda en el período (menos electrones a quitar).
- La reactividad de los no metales aumenta al avanzar en el período (menos electrones a coger).
- Variación de la reactividad en los grupos. A medida que descendemos en un grupo, los electrones de la última capa se encuentran más lejos del núcleo y, por tanto, resultará más fácil quitárselos y, en el caso de los No metales, más difícil el coger electrones.
- La reactividad de los metales aumenta al avanzar en un grupo (mayor tendencia a perder electrones).
- La reactividad de los no metales aumenta cuanto más arriba en el grupo (mayor tendencia a coger electrones)
Regla del octeto
En la formación de compuestos existe una tendencia a coger, perder o compartir electrones entre los átomos y de esta forma parecerse a la configuración electrónica del gas noble más cercano (ocho electrones en la última capa salvo el helio que sólo tiene dos). Esta tendencia se denomina Regla del octeto.[9]
La regla del octeto permite explicar que los metales adquieren la configuración de gas noble perdiendo electrones mientras que los no metales la adquieren compartiéndolos.[10]
Véase también
Referencias
- Loyola, María Dolores de la Llata (2001). Química inórganica. Editorial Progreso. ISBN 9789706413512. Consultado el 10 de noviembre de 2017.
- Química I Primer Semestre Tacaná. IGER. ISBN 9789992292150. Consultado el 10 de noviembre de 2017.
- Antón, Juan Luis; Andrés, Dulce Mª; Barrio, Javier (2009-05). Química 2º Bachillerato. Editex. ISBN 9788497715904. Consultado el 3 de febrero de 2018.
- Introducción a la química descriptiva. Reverte. Consultado el 10 de noviembre de 2017.
- Antón, Juan Luis; Andrés, Dulce Mª; Barrio, Javier (2009-05). Química 2º Bachillerato. Editex. ISBN 9788497715904. Consultado el 3 de febrero de 2018.
- Química. Pearson Educación. 2005. ISBN 9789702606949. Consultado el 10 de noviembre de 2017.
- Sepúlveda, Tania Volke (2005). Suelos contaminados por metales y metaloides: muestreo y alternativas para su remediación. Instituto Nacional de Ecología. ISBN 9789688174920. Consultado el 3 de febrero de 2018.
- Perlado, Francisco Javier Guerra; Andrés, Dulce María (6 de octubre de 2014). Formación Profesional Básica - Ciencias Aplicadas I. Editex. ISBN 9788490039700. Consultado el 10 de noviembre de 2017.
- Química. Pearson Educación. 2005. ISBN 9789702606949. Consultado el 10 de noviembre de 2017.
- Química. Pearson Educación. 2005. ISBN 9789702606949. Consultado el 10 de noviembre de 2017.