钋
釙(拼音:,注音:,粤拼:; 英語:),是一種化學元素,其化學符號为Po,原子序數为84。釙是一種稀有且具有高度放射性的銀白色金屬元素(有時歸為類金屬),對人類極為危險。釙在1898年由玛丽亚·居里和皮埃尔·居里所發現,並得名於玛丽亚·居里的故鄉波蘭(Polska)。
| 外觀 | ||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
銀色 | ||||||||||||||||||||||||||||||||||
| 概況 | ||||||||||||||||||||||||||||||||||
| 名稱·符號·序數 | 釙(polonium)·Po·84 | |||||||||||||||||||||||||||||||||
| 元素類別 | 貧金屬 這個狀態是有爭議的 (有人認為其為類金屬) | |||||||||||||||||||||||||||||||||
| 族·週期·區 | 16 ·6·p | |||||||||||||||||||||||||||||||||
| 標準原子質量 | (209) | |||||||||||||||||||||||||||||||||
| 电子排布 | [氙] 4f14 5d10 6s2 6p4 2, 8, 18, 32, 18, 6 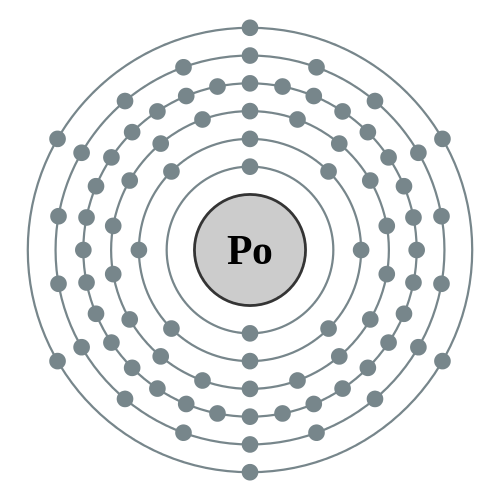 釙的电子層(2, 8, 18, 32, 18, 6) | |||||||||||||||||||||||||||||||||
| 歷史 | ||||||||||||||||||||||||||||||||||
| 發現 | 皮埃爾·居禮和瑪麗·居禮(1898年) | |||||||||||||||||||||||||||||||||
| 分離 | Willy Marckwald(1902年) | |||||||||||||||||||||||||||||||||
| 物理性質 | ||||||||||||||||||||||||||||||||||
| 物態 | 固態 | |||||||||||||||||||||||||||||||||
| 密度 | (接近室温) (alpha) 9.196 g·cm−3 | |||||||||||||||||||||||||||||||||
| 密度 | (接近室温) (beta) 9.398 g·cm−3 | |||||||||||||||||||||||||||||||||
| 熔点 | 527 K,254 °C,489 °F | |||||||||||||||||||||||||||||||||
| 沸點 | 1235 K,962 °C,1764 °F | |||||||||||||||||||||||||||||||||
| 熔化热 | ca. 13 kJ·mol−1 | |||||||||||||||||||||||||||||||||
| 汽化热 | 102.91 kJ·mol−1 | |||||||||||||||||||||||||||||||||
| 比熱容 | 26.4 J·mol−1·K−1 | |||||||||||||||||||||||||||||||||
蒸氣壓
| ||||||||||||||||||||||||||||||||||
| 原子性質 | ||||||||||||||||||||||||||||||||||
| 氧化态 | 6, 5[1], 4, 2, −2 (兩性氧化物) | |||||||||||||||||||||||||||||||||
| 电负性 | 2.0(鲍林标度) | |||||||||||||||||||||||||||||||||
| 电离能 | 第一:812.1 kJ·mol−1 | |||||||||||||||||||||||||||||||||
| 原子半径 | 168 pm | |||||||||||||||||||||||||||||||||
| 共价半径 | 140±4 pm | |||||||||||||||||||||||||||||||||
| 范德华半径 | 197 pm | |||||||||||||||||||||||||||||||||
| 雜項 | ||||||||||||||||||||||||||||||||||
| 晶体结构 | 立方 | |||||||||||||||||||||||||||||||||
| 磁序 | 無磁性 | |||||||||||||||||||||||||||||||||
| 電阻率 | (0 °C)(α) 0.40 µ Ω·m | |||||||||||||||||||||||||||||||||
| 熱導率 | ? 20 W·m−1·K−1 | |||||||||||||||||||||||||||||||||
| 膨脹係數 | (25 °C)23.5 µm·m−1·K−1 | |||||||||||||||||||||||||||||||||
| CAS号 | 7440-08-6 | |||||||||||||||||||||||||||||||||
| 最穩定同位素 | ||||||||||||||||||||||||||||||||||
主条目:釙的同位素
| ||||||||||||||||||||||||||||||||||
釙的化學性質近似於同族的硒與碲,然而,其金屬性則和同週期的相鄰元素鉈、鉛與鉍較為相似。釙沒有穩定的同位素,其所有同位素的半衰期都很短,因此釙在自然界僅極為少量地以238U的衰變產物──210Po(半衰期為138天)的形式存在於鈾礦之中。儘管有半衰期略長於210Po的同位素存在,但這些同位素較難以被生成。在現今,釙主要是以中子照射鉍元素的方式,在毫克等級的數量下,極少量地製造。由於其強烈放射性所導致的化學鍵輻解及衰變熱,絕大多數有關釙化學的研究僅在極微量的尺度下進行。
釙有若干和其放射性有關的應用:包括作為防靜電裝置、中子源、α粒子源、以及毒物。
物理性质
钋在氧族元素中是典型的金属,和硒、碲一样,有挥发性。钋在449.85℃下的蒸汽压约为13Pa,易升华或蒸馏。[3]钋的物理性质,尤其是高熔点、高沸点,和同周期的铊、铅、铋相似,而与碲差别较大。这种横向型不能延伸到化学性质上。
化学性质
钋溶于硝酸可以形成正盐Po(NO3)4和各种碱式盐,溶于硫酸只生成简单阳离子的硫酸盐。当钋溶于盐酸时,起初生成氯化亚钋(PoCl2),但由于α辐射分解溶剂产生臭氧,钋(II)被迅速氧化成钋(IV)。钋不和硫直接作用。[4]
毒性及治疗
关于钋的具体毒性尚未定准。
中国毒理学会在2009年的一篇论文中称“钋-210与同等质量的氰化物相比,毒性要强约2.5亿倍”。[5]
2014年,法国原子能和替代能源委员会的埃里克•安索博洛(Eric Ansoborlo)发表在《自然-化学》中的一篇名为“剧毒的钋(Poisonous polonium)”的文章中谈到“钋的毒性是氰化氢的1万倍,对人体的致死量小于10μg”。这个说法与中国科学院2013年的一篇关于钋与人体健康的文章中所述“大小不及一粒盐(约60μg)的钋-210即可使体重为70 kg的人死亡”相仿。[6]
钋中毒短期内可用二巯基丙烷磺酸钠进行治疗。
使用
- 胖子原子彈 - 二戰末期時,美軍空投至日本長崎的內爆式原子彈,其使用釙-210作為中子源。
- 亞歷山大·利特維年科 - 前蘇聯特工,懷疑遭人以釙-210下毒而身亡。
- 亚西尔·阿拉法特 - 前巴勒斯坦解放运动领袖,1994年诺贝尔和平奖获得者,死因疑為釙-210導致的急性中毒。[7]
參考文獻
- Thayer, John S. . Relativistic Methods for Chemists. Challenges and Advances in Computational Chemistry and Physics. 2010, 10: 78. ISBN 978-1-4020-9974-8. doi:10.1007/978-1-4020-9975-5_2.
- Boutin, Chad. . nist.gov. NIST Tech Beat. [9 September 2014].
- 《无机化学》丛书(张青莲 主编).第五卷 氧硫硒分族.P321.2.5 物理性质
- 《无机化学》丛书(张青莲 主编).第五卷 氧硫硒分族.P326.2.6化学性质
- . old.chntox.org. [2020-01-14].
- . www.cas.cn. [2020-01-14].
- 林宜靜. . 中時電子報. [2013-11-07]. (原始内容存档于2013-11-10).
外部連結
- 元素钋在洛斯阿拉莫斯国家实验室的介紹(英文)
- —— {{LinkForElement|Po| }}(英文)
- 元素钋在The Periodic Table of Videos(諾丁漢大學)的介紹(英文)
- 元素钋在Peter van der Krogt elements site的介紹(英文)
- WebElements.com – {{LinkForElement|Po| }}(英文)