钒
钒(拼音:,注音:,粤拼:;英語:),是一種化學元素,其化學符號为V,原子序數为23,原子量為50.9415 u。釩是一種堅硬、銀灰色,具韌性、可延展的過渡金屬。在自然界中很少發現元素金屬,但是一旦經人工分離,會形成氧化層(鈍化)防止自由態的金屬氧化,使之更穩定存在。
| 外觀 | ||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
银灰色固态金属 | ||||||||||||||||||||||||||||||||||||||
| 概況 | ||||||||||||||||||||||||||||||||||||||
| 名稱·符號·序數 | 钒(Vanadium)·V·23 | |||||||||||||||||||||||||||||||||||||
| 元素類別 | 过渡金属 | |||||||||||||||||||||||||||||||||||||
| 族·週期·區 | 5 ·4·d | |||||||||||||||||||||||||||||||||||||
| 標準原子質量 | 50.9415(1) | |||||||||||||||||||||||||||||||||||||
| 电子排布 | [氩] 3d3 4s2 2,8,11,2 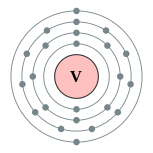 钒的电子層(2,8,11,2) | |||||||||||||||||||||||||||||||||||||
| 歷史 | ||||||||||||||||||||||||||||||||||||||
| 發現 | 安德烈·曼纽尔·德·里奥(1801年) | |||||||||||||||||||||||||||||||||||||
| 分離 | 尼尔斯·加布里埃尔·塞夫斯特瑞姆(1830年) | |||||||||||||||||||||||||||||||||||||
| 命名 | 尼尔斯·加布里埃尔·塞夫斯特瑞姆(1830年) | |||||||||||||||||||||||||||||||||||||
| 物理性質 | ||||||||||||||||||||||||||||||||||||||
| 物態 | 固态 | |||||||||||||||||||||||||||||||||||||
| 密度 | (接近室温) 6.0 g·cm−3 | |||||||||||||||||||||||||||||||||||||
| 熔点 | 2183 K,1910 °C,3470 °F | |||||||||||||||||||||||||||||||||||||
| 沸點 | 3680 K,3407 °C,6165 °F | |||||||||||||||||||||||||||||||||||||
| 熔化热 | 21.5 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||
| 汽化热 | 444 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||
| 比熱容 | 24.89 J·mol−1·K−1 | |||||||||||||||||||||||||||||||||||||
蒸氣壓
| ||||||||||||||||||||||||||||||||||||||
| 原子性質 | ||||||||||||||||||||||||||||||||||||||
| 氧化态 | +5,+4,+3,+2,+1,-1 (两性) | |||||||||||||||||||||||||||||||||||||
| 电离能 | 第一:650.9 kJ·mol−1 第二:1414 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||
| 原子半径 | 134 pm | |||||||||||||||||||||||||||||||||||||
| 共价半径 | 153±8 pm | |||||||||||||||||||||||||||||||||||||
| 雜項 | ||||||||||||||||||||||||||||||||||||||
| 晶体结构 | 体心立方 | |||||||||||||||||||||||||||||||||||||
| 磁序 | 顺磁性 | |||||||||||||||||||||||||||||||||||||
| 電阻率 | (20 °C)197 n Ω·m | |||||||||||||||||||||||||||||||||||||
| 熱導率 | 30.7 W·m−1·K−1 | |||||||||||||||||||||||||||||||||||||
| 热膨胀系数 | (25 ℃)8.4 µm/(m·K) | |||||||||||||||||||||||||||||||||||||
| 聲速(細棒) | (20 °C)4560 m·s−1 | |||||||||||||||||||||||||||||||||||||
| 杨氏模量 | 128 GPa | |||||||||||||||||||||||||||||||||||||
| 剪切模量 | 47 GPa | |||||||||||||||||||||||||||||||||||||
| 体积模量 | 160 GPa | |||||||||||||||||||||||||||||||||||||
| 泊松比 | 0.37 | |||||||||||||||||||||||||||||||||||||
| 莫氏硬度 | 6.7 | |||||||||||||||||||||||||||||||||||||
| 布氏硬度 | 750 MPa | |||||||||||||||||||||||||||||||||||||
| CAS号 | 7440-62-2 | |||||||||||||||||||||||||||||||||||||
| 最穩定同位素 | ||||||||||||||||||||||||||||||||||||||
主条目:钒的同位素
| ||||||||||||||||||||||||||||||||||||||
1801年 Andrés Manuel del Río在墨西哥發現了一種釩化合物,他分析了一種新的含鉛礦物,他稱之為⌈褐色鉛⌋,並根據其質量推測是一種新元素的存在,他稱之為erythronium(源自希臘語,意義為⌈紅色⌋,ἐρυθρόν,eruthrón)因為加熱後大多數鹽變成紅色。 四年後,他(錯誤地)被其他科學家說服,赤黴素與鉻相同。1830年, Nils Gabriel Sefström生成了釩的氯化物,進而證明了一種新的元素,他將這種“釩”命名為斯堪的納維亞的美女和生育女神Vanadís(Freyja)。 這兩個名字都歸因於釩化合物中廣泛的顏色。 Del Rio的鉛礦石後來因其釩含量而更名為釩鉛礦。 1867年亨利恩菲爾德羅斯科得到了純的釩元素。
釩天然存在於約65種礦物和化石燃料沉積物中。它是由中國和俄羅斯的鋼鐵冶煉渣中所得到。其他國家則直接從磁鐵礦、重油煙塵或鈾礦開採的副產品中生產。 它主要用於製造特種鋼合金,如高速工具鋼。最重要的工業用途為釩化合物五氧化二釩用作生產硫酸的催化劑。 用於儲能的釩氧化還原電池可能是未來的重要應用。
在少數生物中發現了大量的釩離子,可能是毒素。 氧化物和一些其他釩鹽具有中等毒性。 特別是在海洋中,釩被一些生命作為酶的活性中心,例如一些海藻的釩溴過氧化物酶。
特性
钒為一中等硬度可延展的銀灰過渡金屬,有些描述形容它很「軟」,應是因為它的延展性。不易腐蚀,在碱、硫酸和盐酸中它相当稳定。在933K(660 ℃)以上的温度中它氧化为五氧化二钒(V2O5)。钒的结构强度相当高。
在氧化物中钒一般显+5价,但也有+2、+3和+4价的氧化物存在,不过它们比较容易过渡为+5价的氧化物。2价和3价的钒氧化物是碱性的,4价的氧化物是两性的,5价的氧化物是酸性的。

一个很有趣的试验是用锌来还原无色的钒酸铵(NH4VO3)。在试验的过程中钒相继被还原成蓝色的四价钒、绿色的三价钒、紫蓝色的二价钒,随后低价的钒又会被空气中的氧氧化为金黃色的五价钒。由于钒的价数很容易改变,它也经常被用做催化剂。+1价的钒很少出现。理论上0、-1和-3价的钒也有可能。
应用
大约80%的钒和铁一起作为钢裡的合金元素。含钒的钢很硬很坚实,但一般其钒含量少于1%。
历史
1801年西班牙矿物学家安德烈·曼纽尔·德·里奥在墨西哥城在一个铅矿中首先发现了钒,但他错误地以为他所发现的只不过是一种不纯的铬。1831年瑞典化学家尼尔斯·加布里埃尔·塞夫斯特瑞姆在与铁矿做试验时重新发现了钒,同年弗里德里希·维勒证实了德·里欧的发现。1867年亨利·英弗尔德·罗斯用氢还原亚氯酸化钒(III)首次得到了纯的钒。
塞夫斯特瑞姆给钒按日尔曼神话中美丽女神的名字起了名,因为钒的化合物色彩缤纷。
生理
在生物体内钒是一些酶的必要组成部分。一些固氮的微生物使用含钒的酶来固定空气中的氮。
鼠和鸡也需要少量的钒,缺钒会阻碍它们的生长和繁殖。含钒的血红蛋白存在于海鞘类动物中。
一些含钒的物质具有类似胰岛素的效应,也许可以用来治疗糖尿病。
同位素
釩共有31種同位素,其中51V穩定。
来源
在大自然中钒一般以化合物存在。约65种钒的化合物在自然中出现,其中有
- 硫化钒 (VS4)
- 绿硫钒矿 (VS2或V2S4)
- 钒铅矿 [Pb5(VO4)3Cl]
- 钒云母 [KV2(AlSi3O10)(OH)2]
- 钒酸钾铀矿 [K2(UO2)2(VO4)2·3H2O]
- 磁铁矿一般含1-2%的钒
- 钒钛磁铁矿也是是钒的来源之一
在矾土和石油、煤、油页岩中也含有大量钒,特别是委内瑞拉和加拿大的石油中能找到钒。光谱分析发现在太阳和一些恒星的表面也有钒。
生产
纯的金属钒一般是用钾在高压下将五氧化二钒还原而得到的。大多数钒是其它矿物加工时的副产品。工业上也可以以铝,焦炭还原五氧化二钒生产纯钒。
化合物
五氧化二釩是釩最重要的化合物,常被用来做催化剂、染料和固色剂。五氧化二钒加熱可放出氧氣,且這個反應是可逆的。五氧化二钒的性質可催化二氧化硫、苯和萘的氧化反應,在工業上用來製造硫酸、鄰苯二甲酐和順丁烯二酐。五氧化二钒是橙色的,具有毒性,不同于大多数金属氧化物,五氧化二钒微溶于水。它是兩性化合物,可以与酸和碱反应。它也是氧化劑。

注意
- 钒很易燃。
- 钒的化合物毒性很高。
- 含钒的尘埃被吸入后会导致肺癌。
参考文献
外部連結
- 元素钒在洛斯阿拉莫斯国家实验室的介紹(英文)
- —— {{LinkForElement|V| }}(英文)
- 元素钒在The Periodic Table of Videos(諾丁漢大學)的介紹(英文)
- 元素钒在Peter van der Krogt elements site的介紹(英文)
- WebElements.com – {{LinkForElement|V| }}(英文)