铬
鉻(拼音:,注音:,粤拼:;英語:;源于拉丁語:,轉寫为chrōma,直譯为顏料),是一種化學元素,其化學符號为Cr,原子序數为24,原子量為51.9961 u,在第六族元素中排行首位。鉻元素是一種銀灰色,具金屬光澤,且硬而脆的過渡金屬[2]。鉻是一種高價值的金屬,其經高度拋光後,仍能抵抗鏽蝕;鉻亦為不鏽鋼的主要添加物,為其提供防蝕特性。拋光的鉻金屬可以反射約70%可見光以及近乎90%紅外光[3]。 其命名源自於希臘語χρῶμα(拉丁化:chrōma),原意為「色彩或顏料」[4],因為大多數鉻的化合物都具有顏色。
| 外觀 | ||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
銀色、具光澤的金屬鉻 | ||||||||||||||||||||||||||||||||||||||||||||||
| 概況 | ||||||||||||||||||||||||||||||||||||||||||||||
| 名稱·符號·序數 | 鉻(Chromium)·Cr·24 | |||||||||||||||||||||||||||||||||||||||||||||
| 元素類別 | 過渡元素 | |||||||||||||||||||||||||||||||||||||||||||||
| 族·週期·區 | 6 ·4·d | |||||||||||||||||||||||||||||||||||||||||||||
| 標準原子質量 | 51.9961(6) | |||||||||||||||||||||||||||||||||||||||||||||
| 电子排布 | [Ar] 3d5 4s1 2, 8, 13, 1 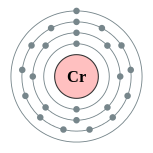 鉻的电子層(2, 8, 13, 1) | |||||||||||||||||||||||||||||||||||||||||||||
| 歷史 | ||||||||||||||||||||||||||||||||||||||||||||||
| 發現 | 路易-尼古拉·沃克蘭(1794年) | |||||||||||||||||||||||||||||||||||||||||||||
| 分離 | 路易-尼古拉·沃克蘭(1797年) | |||||||||||||||||||||||||||||||||||||||||||||
| 物理性質 | ||||||||||||||||||||||||||||||||||||||||||||||
| 物態 | 固體 | |||||||||||||||||||||||||||||||||||||||||||||
| 密度 | (接近室温) 7.19 g·cm−3 | |||||||||||||||||||||||||||||||||||||||||||||
| 熔点時液體密度 | 6.3 g·cm−3 | |||||||||||||||||||||||||||||||||||||||||||||
| 熔点 | 2180 K,1907 °C,3465 °F | |||||||||||||||||||||||||||||||||||||||||||||
| 沸點 | 2944 K,2671 °C,4840 °F | |||||||||||||||||||||||||||||||||||||||||||||
| 熔化热 | 21.0 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||
| 汽化热 | 339.5 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||
| 比熱容 | 23.35 J·mol−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||
蒸氣壓
| ||||||||||||||||||||||||||||||||||||||||||||||
| 原子性質 | ||||||||||||||||||||||||||||||||||||||||||||||
| 氧化态 | +6, +5, +4, +3, +2, +1, -1, -2 (強酸性氧化物) | |||||||||||||||||||||||||||||||||||||||||||||
| 电负性 | 1.66(鲍林标度) | |||||||||||||||||||||||||||||||||||||||||||||
| 电离能 | 第一:652.9 kJ·mol−1 第二:1590.6 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||
| 原子半径 | 128 pm | |||||||||||||||||||||||||||||||||||||||||||||
| 共价半径 | 139±5 pm | |||||||||||||||||||||||||||||||||||||||||||||
| 雜項 | ||||||||||||||||||||||||||||||||||||||||||||||
| 晶体结构 | 體心立方 | |||||||||||||||||||||||||||||||||||||||||||||
| 磁序 | AFM (即SDW[1]) | |||||||||||||||||||||||||||||||||||||||||||||
| 電阻率 | (20 °C)125 n Ω·m | |||||||||||||||||||||||||||||||||||||||||||||
| 熱導率 | 93.9 W·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||
| 膨脹係數 | (25 °C)4.9 µm·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||
| 聲速(細棒) | (20 °C)5940 m·s−1 | |||||||||||||||||||||||||||||||||||||||||||||
| 杨氏模量 | 279 GPa | |||||||||||||||||||||||||||||||||||||||||||||
| 剪切模量 | 115 GPa | |||||||||||||||||||||||||||||||||||||||||||||
| 体积模量 | 160 GPa | |||||||||||||||||||||||||||||||||||||||||||||
| 泊松比 | 0.21 | |||||||||||||||||||||||||||||||||||||||||||||
| 莫氏硬度 | 8.5 | |||||||||||||||||||||||||||||||||||||||||||||
| 維氏硬度 | 1060 MPa | |||||||||||||||||||||||||||||||||||||||||||||
| 布氏硬度 | 1120 MPa | |||||||||||||||||||||||||||||||||||||||||||||
| CAS号 | 7440-47-3 | |||||||||||||||||||||||||||||||||||||||||||||
| 最穩定同位素 | ||||||||||||||||||||||||||||||||||||||||||||||
主条目:鉻的同位素
| ||||||||||||||||||||||||||||||||||||||||||||||
| 本頁面使用旁註標記,若瀏覽器不,標音會顯示在文字後方,如:衣()。 |
鉻鐵合金是由鉻鐵礦通過矽熱或鋁熱反應,再和鉻金屬經由鍛燒及浸濾過程,接著以碳元素和鋁金屬還原而生成的。鉻金屬的價值在於其具有高度耐腐蝕性和硬度。鋼鐵生產中的一個重大發展是發現藉由添加金屬鉻形成不銹鋼,可使鋼材具有高度耐腐蝕和褪色的特性。不銹鋼和鍍鉻(使用電鍍法)共佔商業用途的85%。
在美國,三價鉻離子(Cr(III))被認為是人體的必須營養素,用於胰島素、糖和脂質代謝[5],然而在2014年,歐盟歐洲食品安全局得出結論,認定目前沒有足夠證據證實鉻元素是不可或缺的營養素[6]。
鉻金屬及三價鉻離子(Cr(III))不具毒性,但六價鉻離子(Cr(VI))具有毒性且為致癌物質,產生廢棄鉻的場所需要進行環境清除。
字源
鉻由發現者路易-尼古拉·沃克蘭命名為法語:,源自希臘語「」(拉丁化:),字面意思是顏色或顏料[7][8],因為由這種元素構成的化合物擁有許多不同顏色。是美式英文與拉丁語,根據,加上金屬離子常用的詞尾-ium之後形成[9]。法文与英式英文为,德文为[10]。在現代標準漢語中,鉻的讀音爲(音同「各」)。
歷史
1761年,法國人約翰·戈特洛布·萊曼(Johann Gottlob Lehmann)在烏拉山區發現一種橘紅色的金屬礦,取名為西伯利亞紅鉛,但這種礦石實際上由铬铅矿構成。1770年,彼得·西蒙·帕拉斯在同一個地點,見到這種礦石。這種金屬被帶回歐洲後,被當成顏料,使用於油畫等地方。當時歐洲鉻鉛礦都需要由俄國輸入,產量不大。
1797年,法国人路易-尼古拉·沃克蘭得到一些铬铅矿樣本。經過與鹽酸混合,他從中製作出三氧化鉻。1798年,在加熱三氧化鉻溶液之後,沃克朗從中分離出鉻,確認為化學元素之一。
1994年,中國兵馬俑二號坑開挖, 坑中取出來的一批秦朝青銅劍經過檢驗後發現外層含有約10微米的鉻鹽化合物,可惜使用的塗佈工藝已失傳,當初的實際發現年代與是否擁有鉻提煉法依舊不明。
来源
自然界沒有游離狀態的鉻,主要的礦物是鉻鉛礦(Chromite, (Fe,Mg)Cr2O4)。
主要分布在东非大裂谷、乌拉尔褶皱带、阿尔卑斯—喜马拉雅褶皱带、环太平洋矿带。南非与哈萨克斯坦占世界储量的95%。此外,津巴布韦、阿尔巴尼亚、土耳其等国储量较高。
中国严重缺乏铬资源,保有铬铁矿矿石1000万吨。铬铁矿石年产量约20万吨。由于中国是不锈钢生产大国,铬严重依赖进口。
美国地质调查局发布的数据显示,2013年和2014年,全球铬年产量如下(单位千吨):
| 国家 | 2000年 | 2014年 |
|---|---|---|
| 南非 | 13650 | 15000 |
| 哈萨克斯坦 | 3700 | 4050 |
| 土耳其 | 3300 | 2355 |
| 印度 | 2950 | 3000 |
| 其他国家 | 5150 | 4600 |
| 世界储量 | 28800 | 29000 |
性质
物理性质
鉻是元素週期表中第四個被發現的過渡金屬,其電子組態為[Ar]3d54s1,鉻是週期表中基態電子組態違反遞建原理的第一個元素,此現象也陸續在其他元素的電子組態中出現,像是銅(Cu)、鈮(Nb)和鉬(Mo)[11]。會發生這個現象,乃是相同軌域中兩個電子發生排斥所造成。 遵守遞建原理的元素,其將電子躍遷至較高能階所需的能量極大,不足以彌補其減少成對電子間的斥力所降低的能量[12];然而在3d過渡金屬中,4s軌域與鄰近較高能階的3d軌域間,能隙非常小,而3d軌域擁有五個等能階的軌域,其相同自旋的電子可以互換而降低能量,獲得穩定。 以鉻為例,依照遞建原理,電子組態應為[Ar]4s23d4,但若電子組態為[Ar]4s13d5,使4s和3d軌域皆呈現半填滿狀態,則可降低能量,使之更穩定。
化学性质
铬在室温下化学性质稳定,在空气中生成保护膜。可溶于稀盐酸和稀硫酸,在冷的浓硝酸或王水中钝化。[13]
化合物
铬的氧化离子铬酸根CrO2−
4 呈黄色是常见的氧化剂。重铬酸根Cr
2O2−
7呈橙色。铬离子Cr3+
呈蓝紫色或绿色。
| 铬的氧化态[14] | |
|---|---|
| −2 | Na 2[Cr(CO) 5] |
| −1 | Na 2[Cr 2(CO) 10] |
| 0 | Cr(C 6H 6) 2 |
| +1 | K 3[Cr(CN) 5NO] |
| +2 | CrCl 2 |
| +3 | CrCl 3 |
| +4 | K 2CrF 6 |
| +5 | K 3CrO 8 |
| +6 | K 2CrO 4 |
同位素
铬共有28个同位素,其中三个是稳定的,即52Cr、53Cr和54Cr。52Cr的丰度最高,约83.789%。
應用
大多用於製不銹鋼等特殊鋼,例如:汽車零件、工具、磁帶、錄影帶、菜刀等廚房用品。可以提升鋼的強度又具極佳的耐熱性,使用於製造飛機引擎及核能器械用的超合金(超耐熱抗蝕合金)及鍍覆等用途。[15]
镀铬分为防护装饰性镀铬和耐磨镀铬两大类。前者是防止基体金属生鏽和美化产品外观,后者是提高机械零件的硬度、耐磨、耐蚀和耐温等性能。镀铬层具有很高的硬度和很低的摩擦系数。装饰镀铬是在光亮的底层镀上0.25~2um的铬层。多孔铬主要用于气缸内腔、活塞环上,利用其微孔吸入的润滑油来提高零件的耐磨性。镀黑铬层则用于需要消光而又耐磨的零件上。镀乳白铬主要用于各种量具。[16]
鉻可用來製作顏料「鉻綠」及「鉻黃」。
三價鉻的生理作用
铬是人体必需的微量元素,在肌体的糖代谢和脂代谢中发挥特殊作用。三价的铬是对人体有益的元素,而六价铬是有毒的。人体对无机铬的吸收利用率极低,不到1%;人体对有机铬的利用率可达10-25%。铬在天然食品中的含量较低、均以三价的形式存在。
确切地说,铬的生理功能是与其它控制代谢的物质一起配合起作用,如激素、胰岛素、各种酶类、细胞的基因物质(DNA和RNA)等。铬的生理功能主要有:
- 是葡萄糖耐量因子的组成部分,对调节体内糖代谢、维持体内正常的葡萄糖耐量起重要作用。
- 影响机体的脂质代谢,降低血中胆固醇和甘油三酯的含量,预防心血管疾病。
- 是核酸类(DNA和RNA)的稳定剂,可防止细胞内某些基因物质的突变并预防癌症。
正常健康成人每天尿裡流失约1微克铬。
啤酒酵母、废糖蜜、干酪、蛋、肝、苹果皮、香蕉、牛肉、面粉、鸡以及马铃薯等为铬的主要来源。
六價鉻的危害
- 危害途径:吸入、皮肤接触等。
对皮肤
皮肤直接接触铬化合物所造成的伤害:
铬性皮肤溃疡(铬疮)
铬化合物并不损伤完整的皮肤,但当皮肤擦伤而接触铬化合物时即可发生伤害作用。铬性皮肤溃疡的发病率偶然性较高,主要与接触时间长短,皮肤的过敏性及个人卫生习惯有关。铬疮主要发生于手、臂及足部,但只要皮肤发生破损,不管任何部位,均可发生。指甲根部是暴露处,容易积留髒物,皮肤也最易破损,因此这些部位也易形成铬疮。形成铬疮前,皮肤最初出现红肿,具搔痒感,不作适当治疗可侵入深部。溃疡上盖有分泌物的硬痂,四周部隆起,中央深而充满腐肉,边缘明显,呈灰红色,局部疼痛,溃疡部呈倒锥形,溃疡面较小,一般不超过3mm,有时也可大至12—30mm,或小至针尖般大小,若忽视治疗,进一步发展可深放至骨部,剧烈疼痛,癒合甚慢。
铬性皮炎及湿疹
接触六价铬也可发生铬性皮炎及湿疹,患处皮肤搔痒并形成水泡,皮肤过敏者接触铬污染物数天后即可发生皮炎,铬过敏期长达3—6月,湿疹常发生于手及前臂等暴露部份,偶尔也发生在足及踝部,甚至脸部、背部等。
铬性鼻炎
接触铬盐常见的呼吸道职业病是铬性鼻炎,该病早期症状为鼻粘膜充血,肿胀、鼻腔干燥、搔痒、出血,嗅觉减退,粘液分泌增多,常打喷嚏等,继而发生鼻中隔溃疹,溃疹部位一般在鼻中隔软骨前下端1.5cm处,无明显疼痛感。
铬性鼻炎根据溃疡及穿孔程度,可为三期:
- 糜烂性鼻炎,鼻中隔粘膜縻烂,呈灰白色斑点。
- 溃疡性鼻炎,鼻中隔变薄,鼻粘膜呈凹性缺损,表面有浓性痂盖,鼻中粘膜苍白,嗅觉明显衰退。
- 鼻中隔穿孔,鼻中隔软骨可见圆形成三角形孔洞穿孔处有黄色痂,鼻粘膜萎缩,鼻腔干燥。
对眼及耳
眼皮及角膜接触铬化合物可能引起刺激及溃疡,症状为眼球结膜充血、有异物感、流泪刺痛、视力减弱,严重时可导致角膜上皮脱落。
铬化合物侵蚀鼓膜及外耳引起溃疡仅偶然发生。
对肠胃道
误食入六价铬化合物可引起口腔粘膜增厚,水肿形成黄色痂皮,反胃呕吐,有时带血,剧烈腹痛,肝肿大,严重时使循环衰竭,失去知觉,甚至死亡。六价铬化合物在吸入时是有致癌性的,会造成肺癌。[17]
全身中毒
此种情况甚少,症状是:头痛消瘦,肠胃失调,肝功能衰竭,肾脏损伤,单接血球增多,血钙增多及血磷增多等。
急救措施
- 皮肤接触:脱去被污染的衣着,用流动清水冲洗。
- 眼睛接触:立即用大量流动清水冲洗,再用氯霉素眼药水或用磺胺钠眼药水滴眼,并使用抗菌眼膏每日三次,严重时立刻就医。
- 吸入:迅速脱离现场至空气新鲜处。严重时立刻就医。
- 食入:立即用亚硫酸钠溶液洗胃解毒,口服1%氧化镁稀释溶液,喝牛奶和蛋清等,就医。
参考资料
- Fawcett, Eric. . Reviews of Modern Physics. 1988, 60: 209. doi:10.1103/RevModPhys.60.209.
- Brandes, EA; Greenaway, HT; Stone, HEN. . Nature. 1956, 178 (4533): 587. Bibcode:1956Natur.178..587B. doi:10.1038/178587a0.
- Coblentz, WW; Stair, R. (PDF). National Institute of Standards and Technology. NIST Publications. [11 October 2018]. (原始内容存档 (PDF)于2020-04-27).
- χρῶμα (页面存档备份,存于), Henry George Liddell, Robert Scott, A Greek-English Lexicon, on Perseus
- . Office of Dietary Supplements, US National Institutes of Health. 2016 [26 June 2016]. (原始内容存档于2019-07-13).
- . European Food Safety Authority. 18 September 2014 [20 March 2018]. (原始内容存档于2019-07-13).
- . Allied Publishers. : 238. ISBN 978-81-8424-329-1.
- David Shubert; John Leyba. . Springer Publishing Company. 15 March 2013: 46–. ISBN 978-0-8261-1043-5.
- Pierre-Henri Counsin, Lorna Sinclair and etc. (编). . U.K.: Collins. 2006年: 79. ISBN 0007221088.
- Jessica Elzea Kogel. . SME. 2006: 309 [2015-05-01]. ISBN 978-0-87335-233-8. (原始内容存档于2017-02-25).
chromium is the American name of the element, chrome is the British and French name, chrom is the German name, and ....
。 - . CasaXPS. Casa Software Ltd. 2005 [10 March 2019]. (原始内容存档于2019-07-28).
- Schwarz, W. H. Eugen. (PDF). Journal of Chemical Education. April 2010, 87 (4): 444–8 [9 November 2018]. Bibcode:2010JChEd..87..444S. doi:10.1021/ed8001286. (原始内容存档 (PDF)于2018-12-22).
- 《化学元素综论》. 周公度等. 科学出版社. P83. 24 铬
- Greenwood, Norman N.; Earnshaw, Alan. 2nd. Butterworth-Heinemann. 1997. ISBN 978-0-08-037941-8.
- 世界資源真相和你想的不一樣;作者:資源問題研究會
- 王忠. . 清华大学出版社. 2005: 302. ISBN 7302116970.
- IARC. (PDF). Lyon: International Agency for Research on Cancer. 1999-11-05 [1990] [2006-07-16]. ISBN 92-832-1249-5. (原始内容 (PDF)存档于2008-12-24).
There is sufficient evidence in humans for the carcinogenicity of chromium[VI] compounds as encountered in the chromate production, chromate pigment production and chromium plating industries.
外部連結
- 元素铬在洛斯阿拉莫斯国家实验室的介紹(英文)
- —— {{LinkForElement|Cr| }}(英文)
- 元素铬在The Periodic Table of Videos(諾丁漢大學)的介紹(英文)
- 元素铬在Peter van der Krogt elements site的介紹(英文)
- WebElements.com – {{LinkForElement|Cr| }}(英文)