镭
镭(拼音:,注音:,粤拼:;英語:;舊譯鈤[註 1]、銧),是一種化學元素,其化學符號为Ra,原子序數为88,是一种带有放射性的银白色碱土金属,稀有且贵重,每克约100美金。
| 外觀 | ||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
銀白色金屬 | ||||||||||||||||||||||||||||||||||
| 概況 | ||||||||||||||||||||||||||||||||||
| 名稱·符號·序數 | 鐳(Radium)·Ra·88 | |||||||||||||||||||||||||||||||||
| 元素類別 | 鹼土金屬 | |||||||||||||||||||||||||||||||||
| 族·週期·區 | 2 ·7·s | |||||||||||||||||||||||||||||||||
| 標準原子質量 | (226) | |||||||||||||||||||||||||||||||||
| 电子排布 | [Rn] 7s2 2, 8, 18, 32, 18, 8, 2 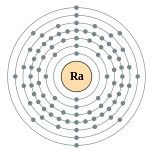 鐳的电子層(2, 8, 18, 32, 18, 8, 2) | |||||||||||||||||||||||||||||||||
| 歷史 | ||||||||||||||||||||||||||||||||||
| 發現 | 皮埃爾·居里和瑪麗·居里(1898年) | |||||||||||||||||||||||||||||||||
| 分離 | 瑪麗·居里(1902年) | |||||||||||||||||||||||||||||||||
| 物理性質 | ||||||||||||||||||||||||||||||||||
| 物態 | 固態 | |||||||||||||||||||||||||||||||||
| 密度 | (接近室温) 5.5 g·cm−3 | |||||||||||||||||||||||||||||||||
| 熔点 | 973 K,700 °C,1292 °F | |||||||||||||||||||||||||||||||||
| 沸點 | 2010 K,1737 °C,3158.6 °F | |||||||||||||||||||||||||||||||||
| 熔化热 | 8.5 kJ·mol−1 | |||||||||||||||||||||||||||||||||
| 汽化热 | 113 kJ·mol−1 | |||||||||||||||||||||||||||||||||
蒸氣壓
| ||||||||||||||||||||||||||||||||||
| 原子性質 | ||||||||||||||||||||||||||||||||||
| 氧化态 | 2(強鹼性) | |||||||||||||||||||||||||||||||||
| 电负性 | 0.9(鲍林标度) | |||||||||||||||||||||||||||||||||
| 电离能 | 第一:509.3 kJ·mol−1 第二:979.0 kJ·mol−1 | |||||||||||||||||||||||||||||||||
| 共价半径 | 221±2 pm | |||||||||||||||||||||||||||||||||
| 范德华半径 | 283 pm | |||||||||||||||||||||||||||||||||
| 雜項 | ||||||||||||||||||||||||||||||||||
| 晶体结构 | 面心立方 | |||||||||||||||||||||||||||||||||
| 磁序 | 無磁性 | |||||||||||||||||||||||||||||||||
| 電阻率 | (20 °C)1 µ Ω·m | |||||||||||||||||||||||||||||||||
| 熱導率 | 18.6 W·m−1·K−1 | |||||||||||||||||||||||||||||||||
| CAS号 | 7440-14-4 | |||||||||||||||||||||||||||||||||
| 最穩定同位素 | ||||||||||||||||||||||||||||||||||
主条目:鐳的同位素
| ||||||||||||||||||||||||||||||||||
镭在1898年由居里夫人及其丈夫皮埃尔·居里在捷克北波希米亚发现。他们发现铀在衰变后,衰变物仍带放射性。镭的英語名称Radium即是放射性的意思。
镭-226為鐳的最穩定同位素,半衰期為1600年,进行α-蜕变,放出α射线和γ射线。它衰变时会放出氡气到大气中。氡仍有放射性,生物吸入後可危害生命。
鐳和鈣屬於同一主族,有著相似的性質。身體在攝取到鐳以後,無法區分鐳和鈣,誤將鐳當作鈣,合成了骨細胞。這些含有鐳的骨細胞中的鐳,緩慢地發生衰變,而衰變過程中發射出的α粒子,就像砲彈一樣,殺傷了細胞。而恰巧,人類的下頜骨是骨細胞中更新最快的,所以也更容易富集被鐳元素替換過的骨細胞。所以,下頜骨也是受放射損傷最嚴重的部分。於是就有了鐳毒頜顏。
镭能够致癌,但是它也能够治療癌症。[1]
相關化學反應
鐳在空氣中相當不穩定,很容易與氮气和氧氣發生反應,生成氮化鐳和氧化鐳:
3 Ra + N2 → Ra3N2
2 Ra + O2 → 2RaO
鐳也可以和水發生反應,生成氫氧化鐳:
Ra + 2 H2O → Ra(OH)2 + H2 ↑
参考文獻
- . [2015-09-04].
- Haynes, William M. (编). 92nd. Boca Raton, FL: CRC Press. 2011. ISBN 1439855110.
- Frame, Paul W. . [30 April 2008]. (原始内容存档于2013-07-23).
註解
- 1903年10月10日:魯迅以筆名“自樹”在東京出版的《浙江潮》月刊第八期上首次發表介紹鐳的文章《說鈤》。但“鈤”亦為化學元素鍺的舊譯,因造成混淆而採用新譯。
外部連結
- 元素镭在洛斯阿拉莫斯国家实验室的介紹(英文)
- —— {{LinkForElement|Ra| }}(英文)
- 元素镭在The Periodic Table of Videos(諾丁漢大學)的介紹(英文)
- 元素镭在Peter van der Krogt elements site的介紹(英文)
- WebElements.com – {{LinkForElement|Ra| }}(英文)
- 居禮夫婦發現了鐳 (页面存档备份,存于)
- Lu Le Laboratory (页面存档备份,存于)
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.