钬
钬(拼音:,注音:,粤拼:;英語:;舊譯錵),是一種化學元素,其化學符號为Ho,原子序數为67,原子量為164.93033 u,属于镧系元素,也是稀土元素之一。钬在常温常压下是固体。 1878年为索里特(J.L.Soret)发现;1879年又被克利夫(P.T.Cleve)发现。第一电离能6.02电子伏特。有金属光泽。与水能缓慢起作用,溶于稀酸。盐类是黄色。氧化物Ho2O2为淡绿色。溶于矿物酸而产生三价离子黄色盐。由氟化钬HoF3·2H2O用钙还原而制得。它和镝一样,是一种能够吸收核分裂所产生的中子的金属。在核子反应炉中,一方面不断燃烧,一方面控制连锁反应的速度。
| 外觀 | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
银白色 | |||||||||||||||||||||||||||||||||||||||||
| 概況 | |||||||||||||||||||||||||||||||||||||||||
| 名稱·符號·序數 | 钬(holmium)·Ho·67 | ||||||||||||||||||||||||||||||||||||||||
| 元素類別 | 镧系元素 | ||||||||||||||||||||||||||||||||||||||||
| 族·週期·區 | 不適用 ·6·f | ||||||||||||||||||||||||||||||||||||||||
| 標準原子質量 | 164.93033(2) | ||||||||||||||||||||||||||||||||||||||||
| 电子排布 | [Xe] 4f11 6s2 2, 8, 18, 29, 8, 2 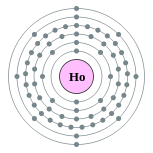 钬的电子層(2, 8, 18, 29, 8, 2) | ||||||||||||||||||||||||||||||||||||||||
| 歷史 | |||||||||||||||||||||||||||||||||||||||||
| 發現 | 马克·德拉方丹(1878年) | ||||||||||||||||||||||||||||||||||||||||
| 物理性質 | |||||||||||||||||||||||||||||||||||||||||
| 物態 | 固体 | ||||||||||||||||||||||||||||||||||||||||
| 密度 | (接近室温) 8.79 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||
| 熔点時液體密度 | 8.34 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||
| 熔点 | 1734 K,1461 °C,2662 °F | ||||||||||||||||||||||||||||||||||||||||
| 沸點 | 2873 K,2600 °C,4712 °F | ||||||||||||||||||||||||||||||||||||||||
| 熔化热 | 17.0 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||
| 汽化热 | 251 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||
| 比熱容 | 27.15 J·mol−1·K−1 | ||||||||||||||||||||||||||||||||||||||||
蒸氣壓
| |||||||||||||||||||||||||||||||||||||||||
| 原子性質 | |||||||||||||||||||||||||||||||||||||||||
| 氧化态 | 3, 2, 1 ((a basic oxide)) | ||||||||||||||||||||||||||||||||||||||||
| 电负性 | 1.23(鲍林标度) | ||||||||||||||||||||||||||||||||||||||||
| 电离能 | 第一:581.0 kJ·mol−1 第二:1140 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||
| 原子半径 | 176 pm | ||||||||||||||||||||||||||||||||||||||||
| 共价半径 | 192±7 pm | ||||||||||||||||||||||||||||||||||||||||
| 雜項 | |||||||||||||||||||||||||||||||||||||||||
| 晶体结构 | 六方密堆积 | ||||||||||||||||||||||||||||||||||||||||
| 磁序 | 顺磁性 | ||||||||||||||||||||||||||||||||||||||||
| 电阻率 | poly: 814 nΩ·m | ||||||||||||||||||||||||||||||||||||||||
| 熱導率 | 16.2 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||
| 热膨胀系数 | poly: 11.2 µm/(m·K) | ||||||||||||||||||||||||||||||||||||||||
| 聲速(細棒) | (20 °C)2760 m·s−1 | ||||||||||||||||||||||||||||||||||||||||
| 杨氏模量 | 64.8 GPa | ||||||||||||||||||||||||||||||||||||||||
| 剪切模量 | 26.3 GPa | ||||||||||||||||||||||||||||||||||||||||
| 体积模量 | 40.2 GPa | ||||||||||||||||||||||||||||||||||||||||
| 泊松比 | 0.231 | ||||||||||||||||||||||||||||||||||||||||
| 維氏硬度 | 410–600 MPa | ||||||||||||||||||||||||||||||||||||||||
| 布氏硬度 | 500–1250 MPa | ||||||||||||||||||||||||||||||||||||||||
| CAS号 | 7440-60-0 | ||||||||||||||||||||||||||||||||||||||||
| 最穩定同位素 | |||||||||||||||||||||||||||||||||||||||||
主条目:钬的同位素
| |||||||||||||||||||||||||||||||||||||||||
性质
化学性质
钬可以在空气中燃烧,发出耀眼白光,产生氧化钬:
- 4 Ho + 3 O2 → 2 Ho2O3
钬能与水反应,与冷水反应较缓慢,而与热水反应较快速:
- 2 Ho (s) + 6 H2O (l) → 2 Ho(OH)3 (aq) + 3 H2 (g)
钬也能与卤素反应:
- 2 Ho (s) + 3 F2 (g) → 2 HoF3 (s) [粉红色]
- 2 Ho (s) + 3 Cl2 (g) → 2 HoCl3 (s) [黄色]
- 2 Ho (s) + 3 Br2 (g) → 2 HoBr3 (s) [黄色]
- 2 Ho (s) + 3 I2 (g) → 2 HoI3 (s) [黄色]
钬较容易溶解于稀硫酸中,生成Ho3+离子,以[Ho(OH2)9]3+配合物出现:[1]
- 2 Ho (s) + 3 H2SO4 (aq) → 2 Ho3+ (aq) + 3 SO2−
4 (aq) + 3 H2 (g)
钬最常见的氧化态是+3。钬溶液中的Ho3+被九个水分子环绕。钬能溶解于酸性溶液。[2]
同位素
钬共有35个同位素,其中165Ho是最稳定的。其余的皆为人工合成的放射性同位素。
来源
就像其他的稀土金属一样,钬不会以单质形式出现。钬一般存在于硅铍钇矿、独居石等稀土矿物中。
参见
- Category:钬化合物
外部連結
- 元素钬在洛斯阿拉莫斯国家实验室的介紹(英文)
- —— {{LinkForElement|Ho| }}(英文)
- 元素钬在The Periodic Table of Videos(諾丁漢大學)的介紹(英文)
- 元素钬在Peter van der Krogt elements site的介紹(英文)
- WebElements.com – {{LinkForElement|Ho| }}(英文)
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.