Osmio
El osmio es un elemento químico de número atómico 76 que se encuentra en el grupo 8 de la tabla periódica de los elementos. Su símbolo es Os.
| Renio ← Osmio → Iridio | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tabla completa • Tabla ampliada | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Azul grisáceo | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Información general | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | Osmio, Os, 76 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie química | Metales de transición | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 8, 6, d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atómica | 190,23 u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [Xe]4f145d66s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza Mohs | 7 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrones por nivel | 2, 8, 18, 32, 14, 2 (imagen) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio medio | 130 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividad | 2,2 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio atómico (calc) | 185 pm (radio de Bohr) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 128 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado(s) de oxidación | 8, 7, 6, 5, 4, 3, 2, 1, 0, -1, -2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Óxido | Levemente ácido | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1.ª energía de ionización | 840 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2.ª energía de ionización | 1600 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado ordinario | Sólido | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad | 22610 kg/m3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusión | 3306 K (3033 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullición | 5285 K (5012 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de vaporización | 627,6 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de fusión | 31,8 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Presión de vapor | 2,52 Pa a 3300 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volumen molar | 8,42·10-6 m3/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Módulo de compresibilidad | 462 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Varios | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | Hexagonal | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor específico | 130 J/(K·kg) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad eléctrica | 10,9·106 S/m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 87,6 W/(K·m) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Módulo de cizalladura | 222 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidad del sonido | 4940 m/s a 293,15 K (20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isótopos más estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Isótopos del osmio | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Valores en el SI y condiciones normales de presión y temperatura, salvo que se indique lo contrario. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Se trata de un metal de transición blanco grisáceo, frágil y sólido. Se clasifica dentro del grupo del platino, y se emplea en algunas aleaciones con platino e iridio. Se encuentra aleado en menas de platino y su tetróxido, OsO4.[1] El osmio es el elemento natural más pesado a igual volumen (es decir, más denso) que existe, con una densidad de 22.59 g/cm³.
Se emplea en síntesis orgánica (como oxidante) y en el proceso de tinción de tejidos (como fijador) para su observación mediante microscopía electrónica, y en otras técnicas biomédicas. Las aleaciones de osmio se emplean en contactos eléctricos, puntas de bolígrafos y otras aplicaciones en las que es necesaria una gran dureza y durabilidad.[2]
El osmio fue descubierto en 1803 por Smithson Tennant, a partir del residuo que quedaba al disolver platino nativo en agua regia. Es un elemento muy escaso en la naturaleza y que se halla en la corteza terrestre en una concentración de 0.0015 ppm. Previamente, los químicos franceses Antoine-François de Fourcroy y Louis Nicolas Vauquelin identificaron un material en el residuo del platino, al que llamaron ptène, pero no pudieron caracterizarlo correctamente al no contar con una cantidad suficiente para aislarlo.[3]
Características

En su forma metálica es de color blanco grisáceo, duro y brillante, incluso a altas temperaturas, aunque es difícil encontrarlo en esta forma. Es más fácil obtener osmio en polvo, aunque expuesto al aire tiende a la formación del tetraóxido de osmio, OsO4, compuesto tóxico (peligroso para los ojos), oxidante enérgico, de un olor fuerte, y volátil. En la corteza terrestre se encuentra junto con otros metales del grupo del platino, generalmente aleado con iridio (y otros en menor cantidad). El osmio es otro de los metales aleados al hierro, níquel e iridio y al igual que estos, la mayor cantidad de osmio nativo se encuentra en el núcleo del planeta que por su alta densidad se hundió y pasó a formar parte de sus componentes. Las aleaciones de osmio e iridio en las que hay mayor cantidad de osmio se conocen como osmiridio, contra las que tienen más iridio, llamadas iridiosmio.
Se conoce también el dióxido de osmio, OsO2, los fluoruros OsF4, OsF5 y OsF6 y los cloruros OsCl2, OsCl3 y OsCl4. Forma asimismo diversos oxoaniones. El osmio en forma pura no se utiliza, se emplea en aleaciones como endurecedor del platino y como catalizador.
Alcanza el estado de oxidación +8, al igual que el rutenio, estado que no alcanza el hierro, que es el elemento cabecera de este grupo. Puede presentar variados estados de oxidación, desde el 0 al +8. Son muy resistentes al ataque por ácidos, disolviéndose mejor por fusión alcalina.
Es el elemento natural de mayor densidad (a presión ambiente) de la Tierra,[4] siendo ligeramente superior a la del iridio, y tiene una de las energías cohesivas y una de las temperaturas de fusión más altas.
Propiedades
Propiedades físicas

El osmio tiene un tinte azul grisáceo y es el elemento estable más denso; es aproximadamente dos veces más denso que el plomo[2] y ligeramente más denso que iridio.[5] Los cálculos de densidad a partir de los datos obtenidos con cristalografía de rayos X permiten obtener los resultados más fiables para estos elementos, dando un valor de 22,587±0,009 g/cm3 para el osmio, ligeramente más denso que el valor de 22,562±0,009 g/cm3 obtenido para el iridio. Ambos metales son casi 23 veces más densos que el agua, y 1 1⁄6 veces más densos que el oro.[6]
El osmio es un metal duro pero quebradizo que permanece con brillo incluso a altas temperaturas. Tiene una compresibilidad muy baja. En consecuencia, su módulo de compresibilidad es extremadamente alto, con valores entre 395 y 462 GPa, comparable a la del diamante, de (443 GPa). La dureza del osmio es moderadamente alta, con un valor de 4 GPa.[7][8][9] Debido a su dureza y fragilidad, presenta una baja presión de vapor (la más baja de los metales del grupo del platino) y un punto de fusión muy alto (el tercero más alto de todos los elementos, después del wolframio y del renio). El osmio sólido es difícil de mecanizar para darle forma.
Propiedades químicas
| Estados de oxidación del osmio | |
|---|---|
| −2 | Na 2[Os(CO) 4] |
| −1 | Na 2[Os 4(CO) 13] |
| 0 | Os 3(CO) 12 |
| +1 | OsI |
| +2 | OsI 2 |
| +3 | OsBr 3 |
| +4 | OsO 2, OsCl 4 |
| +5 | OsF 5 |
| +6 | OsF 6 |
| +7 | OsOF 5 |
| +8 | OsO 4, Os(NCH3) 4 |
El osmio forma compuestos con estados de oxidación que van desde −2 a +8. Los estados de oxidación más comunes son +2, +3, +4 y +8. El estado de oxidación +8 es notable por ser el más alto alcanzado por cualquier elemento químico aparte del +9[10] de iridio y se encuentra solo en xenón, [11][12] rutenio, [13] hasio, [14] y iridio.[15] Los estados de oxidación −1 y −2 representados por dos compuestos reactivos Na
2[Os
4(CO)
13] y Na
2[Os(CO)
4] se utilizan en la síntesis clústeres de osmio.[16][17]
El compuesto más común que exhibe el estado de oxidación +8 es el tetróxido de osmio. Este compuesto tóxico se forma cuando el osmio en polvo se expone al aire. Es un sólido cristalino muy volátil, soluble en agua, amarillo pálido y con un fuerte olor. El polvo de osmio tiene el olor característico del tetróxido de osmio.[1] Este óxido forma osmiatos rojos OsO
4(OH)2−
2 al reaccionar con una base. Con amoníaco, forma el nitro-osmiato OsO
3N−
.[18][19][20] El tetróxido de osmio hierve a 130° C y es un poderoso agente oxidante. Por el contrario, el dióxido de osmio (OsO2) es negro, no volátil y mucho menos reactivo y tóxico.
Solo dos compuestos de osmio tienen aplicaciones importantes: el tetróxido de osmio para la tinción de tejidos orgánicos en microscopía electrónica y para la oxidación de alquenos en síntesis orgánica, y los osmiatos no volátiles para reacciones de oxidación orgánicas.[21]
El pentafluoruro de osmio (OsF5) es un compuesto conocido, pero el trifluoruro de osmio (OsF3) aún no se ha podido sintetizar. Los estados de oxidación más bajos son estabilizados por los halógenos más grandes, de modo que se conocen el tricloruro, tribromuro, triyoduro e incluso diyoduro. El estado de oxidación +1 se conoce solo para el yoduro de osmio (OsI), mientras que varios complejos de carbonilo de osmio, como el triosmio dodecacarbonilo (Os
3(CO)
12), representan el estado de oxidación 0.[18][19][22][23]
En general, los estados de oxidación más bajos del osmio se estabilizan mediante ligandos que son buenos donantes σ (como las aminas) y receptores π (heterociclos que contiene nitrógeno). Los estados de oxidación más altos se estabilizan mediante fuertes donantes σ y π, como O2−
y N3−
.[24]
A pesar de su amplia gama de compuestos en numerosos estados de oxidación, el osmio en forma masiva a temperaturas y presiones normales resiste el ataque de todos los ácidos, incluida el agua regia, pero es atacado por los álcalis fundidos.[25]
Isótopos
El osmio tiene siete isótopos naturales, seis de los cuales son estables: 184
Os, 187
Os, 188
Os, 189
Os, 190
Os y (el más abundante) 192
Os. El 186
Os se somete a desintegración alfa con un periodo de semidesintegración muy largo de (2,0±1,1) 1015 años
, aproximadamente 140 000 veces la edad del universo, que para fines prácticos puede considerarse estable. Se predice la desintegración alfa para los siete isótopos naturales, pero se ha observado solo para el 186
Os, presumiblemente debido a sus vidas medias muy largas. Se predice que el 184
Os y el 192
Os pueden sufrir doble desintegración beta pero esta radioactividad aún no se ha observado.[26]
El 187
Os se deriva del 187
Re (4,56 1010 años
de semivida) y se usa ampliamente en la datación terrestre y de rocas meteoríticas (véase datado por renio-osmio).
También se ha utilizado para medir la intensidad de la meteorización continental en el tiempo geológico y para fijar edades mínimas para la estabilización de las raíces de los de los cratones continentales sobre el manto terrestre. Esta descomposición es una razón por la cual los minerales ricos en renio son anormalmente ricos en 187
Os.[27] Sin embargo, la aplicación más notable de isótopos de osmio en geología ha sido en conjunción con la abundancia de iridio, para caracterizar la capa de cuarzo de impacto en el límite K/Pg que marca la extinción de los dinosaurios no aviarios hace 65 millones de años.[28]
Historia
El osmio fue descubierto en 1803 por Smithson Tennant y William Hyde Wollaston en Londres, Inglaterra.[29] El descubrimiento del osmio está entrelazado con el del platino y los otros metales del grupo del platino. El platino llegó a Europa como platina ("pequeña plata"), habiendo sido encontrado por primera vez a finales del siglo XVII en las minas de plata situadas alrededor de Chocó, en Colombia.[30] El descubrimiento de que este metal no era una aleación, sino un elemento nuevo y distinto, fue publicado en 1748.[31]
Los químicos que estudiaron el platino lo disolvieron en agua regia (una mezcla de ácido clorhídrico y ácido nítrico) para crear sales solubles, y siempre observaban una pequeña cantidad de un residuo oscuro e insoluble.[32] Louis Proust pensó que el residuo era grafito.[32] Hippolyte Victor Collet-Descotils, Antoine-François de Fourcroy y Louis Nicolas Vauquelin también observaron iridio en el residuo de platino negro en 1803, pero no obtuvieron suficiente material para más experimentos.[32] Más tarde, los dos químicos franceses Antoine-François Fourcroy y Nicolas-Louis Vauquelin identificaron un metal en un residuo de platino que llamaron "ptène".[33]
En 1803, Smithson Tennant analizó el residuo insoluble y concluyó que debe contener un nuevo metal. Vauquelin trató el polvo alternativamente con álcali y ácidos[34] y obtuvo un nuevo óxido volátil, que pensó que era de un nuevo metal, al que llamó "pteno", de la palabra griega πτηνος (ptènos) "con alas".[35][36] Sin embargo, Tennant, quien tenía la ventaja de una cantidad mucho mayor de residuos, continuó su investigación e identificó dos elementos previamente descubiertos en el residuo negro, iridio y osmio.[32][34] Obtuvo una solución amarilla (probablemente de cis-[Os (OH) 2O4]2−) por reacciones con hidróxido de sodio a la llama roja. Después de la acidificación, pudo destilar el OsO4[35] formado. Lo denominó osmio en referencia a la palabra griega osme que significa "olor", debido al olor a ceniza y a humo del tetróxido de osmio, muy volátil.[37] El descubrimiento de los nuevos elementos se documentó en una carta a la Royal Society el 21 de junio de 1804.[32][38]
El uranio y el osmio fueron catalizadores eficaces en el proceso de Haber, la reacción de la fijación de nitrógeno e hidrógeno para producir amoníaco, dando suficiente rendimiento para que el proceso sea económicamente rentable. En aquel momento, un grupo de la compañía BASF dirigido por Carl Bosch compró la mayor parte del suministro mundial de osmio para usarlo como catalizador. Poco después, en 1908, el mismo grupo introdujo catalizadores más baratos basados en hierro y óxidos de hierro para las primeras plantas piloto, eliminando la necesidad del costoso y raro osmio.[39]
Hoy en día, el osmio se obtiene principalmente del procesamiento de minerales de platino y de níquel.[40]
Presencia en la naturaleza

El osmio es uno de los elementos pares, lo que lo coloca en la mitad superior de los elementos comúnmente encontrados en el espacio. Sin embargo, es el elemento estable menos abundantes en la corteza de la Tierra, con una fracción de masa promedio de 50 partes por trillón en la corteza continental.[41]
El osmio se encuentra en la naturaleza como un elemento no combinado o en aleación naturales; especialmente en las aleaciones de iridio-osmio, osmiridio (rico en osmio) y iridosmio (rico en iridio).[34] En los depósitos de níquel y cobre, los metales del grupo del platino se presentan como sulfuros (es decir, (Pt, Pd) S)), telúridos (p. ej., PtBiTe), antimoniuros (por ejemplo, PdSb) y arseniuros (por ejemplo, PtAs2). En todos estos compuestos, el platino se intercambia por una pequeña cantidad de iridio y osmio. Al igual que con todos los metales del grupo del platino, el osmio se puede encontrar naturalmente en aleaciones con níquel o cobre nativo.[42]
Dentro de la corteza terrestre, el osmio, como el iridio, se encuentra en las concentraciones más altas en tres tipos de estructura geológica: depósitos ígneos (intrusiones en la corteza desde el manto), cráteres de impacto y depósitos generados a partir de alguna de las estructuras anteriores. Las mayores reservas primarias conocidas se encuentran en el complejo ígneo de Bushveld en Sudáfrica,[43] aunque los grandes depósitos de cobre y níquel cerca de Norilsk en Rusia y en la cuenca de Sudbury en Canadá también son fuentes importantes de osmio. Se pueden encontrar reservas más pequeñas en los Estados Unidos.[43] Los depósitos de aluvión utilizados en la América precolombina en Chocó, Colombia, siguen siendo una fuente de metales del grupo del platino. El segundo gran depósito aluvial se encontró en los montes Urales, Rusia, de donde todavía se extrae.[40][44]
Producción

El osmio se obtiene comercialmente como un subproducto de la minería y el procesamiento de níquel y cobre. Durante el electrorrefinado del cobre y el níquel, los metales nobles como la plata, el oro y los metales del grupo del platino, junto con elementos no metálicos como el selenio y el telurio se depositan en el fondo de la celda como "lodo anódico", que forma el material de partida para su extracción.[45][46] La separación de los metales requiere que primero se pongan en solución, que se puede obtener por varios métodos, dependiendo del proceso de separación y la composición de la mezcla. Dos métodos representativos son la fusión con peróxido de sodio, seguida de la disolución en agua regia, y la disolución en una mezcla de cloro con ácido clorhídrico.[43][47] El osmio, el rutenio, el rodio y el iridio se pueden separar del platino, el oro y los metales básicos por su insolubilidad en agua regia, dejando un residuo sólido. El rodio se puede separar del residuo mediante tratamiento con bisulfato de sodio fundido. El residuo insoluble, que contiene Ru, Os e Ir, se trata con óxido de sodio, en el que el iridio es insoluble, produciendo sales de rutenio y osmio solubles en agua. Después de la oxidación formando óxidos volátiles, el RuO
4 se separa del OsO
4 por precipitación de (NH4)3RuCl6 con cloruro de amonio.
Después de que se disuelve, el osmio se separa de los otros metales del grupo del platino por destilación o extracción con disolventes orgánicos del tetróxido de osmio volátil.[48] El primer método es similar al procedimiento utilizado por Tennant y Wollaston. Ambos métodos son adecuados para la producción a escala industrial. En cualquier caso, el producto se reduce usando hidrógeno, produciendo el metal como un polvo o esponja que puede tratarse usando técnicas de pulvimetalurgia.[49]
Ni empresas mineras ni el Servicio Geológico de los Estados Unidos han publicado cifras de la producción de osmio. En 1971, las estimaciones de la producción de osmio en los Estados Unidos como subproducto de la refinación de cobre fueron de 2000 onzas troy (62 kg).[50] En 2017, la importación estimada de osmio en los Estados Unidos para el consumo fue de 90 kg.[51]
Aplicaciones
|
Debido a la volatilidad y la toxicidad extrema de su óxido, el osmio rara vez se usa en estado puro, sino que a menudo se alea con otros metales para aplicaciones de alta resistencia al desgaste. Las aleaciones de osmio, como el osmiridio, son muy duras, y junto con otros metales del grupo del platino, se usan en las puntas de plumas estilográficas, ejes de instrumentos y contactos eléctricos, ya que pueden resistir el desgaste de un funcionamiento continuo. También se usaron para las puntas de los fonógrafos de estilete durante la época de los últimos discos a 78 rpm y el principio de la era discográfica marcada por la aparición de los formatos "LP" y "45", alrededor de 1945 a 1955. Las puntas de aleación de osmio eran significativamente más duraderas que las puntas de aguja de acero y cromo, pero se desgastaban mucho más rápido que las más costosas puntas de zafiro y diamante, por lo que fueron sustituidas por estas últimas.[54]
El tetróxido de osmio se ha utilizado en la detección de huellas dactilares[55] y en la tinción de tejidos grasos para microscopía óptica y electrónica. Como oxidante fuerte, reticula los lípidos principalmente al reaccionar con enlaces carbono-carbono insaturados y, por lo tanto, fija las membranas biológicas en muestras de tejidos y las tiñe simultáneamente. Debido a que los átomos de osmio son extremadamente densos en electrones, la tinción de osmio mejora en gran medida el contraste de la imagen en los estudios con microscopio electrónico de transmisión (TEM) de materiales biológicos. De lo contrario, esos materiales de carbono tienen un contraste TEM muy débil (véase la imagen adjunta).[21] Otro compuesto de osmio, el ferrocianuro de osmio (OsFeCN), exhibe una acción similar de fijación y tinción.[56]
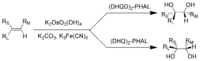
El tetróxido y su derivado, el osmiato de potasio, son oxidantes importantes en síntesis orgánica. Para la dihidroxilación asimétrica de Sharpless, que usa osmiato para la conversión de un enlace doble en un diol vecinal,[57] Karl Barry Sharpless recibió el Premio Nobel de Química en 2001.[58][59] El OsO4 es muy costoso para este uso, por lo que el KMnO4 a menudo se usa en su lugar, aunque los rendimientos de este reactivo químico más barato son menores.
En 1898, un químico austriaco Auer von Welsbach desarrolló la Oslamp con un filamento hecho de osmio, que introdujo comercialmente en 1902. Después de unos pocos años, el osmio fue reemplazado por el wolframio, un metal más estable. El tungsteno tiene el punto de fusión más alto entre todos los metales, y su uso en bombillas aumenta la eficacia luminosa y la vida útil de las lámparas incandescentes.[35]
El fabricante de bombillas Osram (fundado en 1906, cuando tres compañías alemanas, Auer-Gesellschaft, AEG y Siemens & Halske, combinaron sus instalaciones de producción de lámparas) derivaron su nombre de los nombres en alemán de los dos elementos utilizados en los filamentos: osmium y wolfram (osmio y wolframio).[60]
Al igual que el paladio, el osmio en polvo absorbe eficazmente los átomos de hidrógeno. Esto podría hacer que sea un candidato potencial para un electrodo de batería de hidruro metálico. Sin embargo, es caro, y reaccionaría con el hidróxido de potasio, el electrolito de batería más común.[61]
El osmio tiene una alta reflectividad en el rango de la radiación ultravioleta del espectro electromagnético; por ejemplo, a 600 Å, el osmio tiene una reflectividad dos veces mayor que la del oro.[62] Esta alta reflectividad es deseable en la espectroscopia ultravioleta-visible utilizada en satélites artificiales, que tienen tamaños de espejo reducidos debido a limitaciones de espacio. Los espejos con revestimiento de osmio se usaron en varias misiones espaciales a bordo del Transbordador STS, pero pronto se hizo evidente que los radicales de oxígeno en la órbita terrestre baja son lo suficientemente abundantes como para deteriorar significativamente la capa de osmio.[63]
El único uso clínico conocido del osmio es en la operación de sinovectomía, practicada en pacientes artríticos en Escandinavia.[64] Implica la administración local de tetróxido de osmio (OsO4), que es un compuesto altamente tóxico. La falta de informes de efectos secundarios a largo plazo sugiere que el osmio en sí mismo puede ser biocompatible, aunque esto depende del compuesto de osmio administrado. En 2011, se informó que los compuestos de osmio (VI)[65] y osmio (II)[66] mostraban actividad anticancerígena in vivo, lo que indicaba un futuro prometedor para el uso de compuestos de osmio como fármacos contra el cáncer.[67]
Referencias
- Mager Stellman, J. (1998). «Osmium». Encyclopaedia of Occupational Health and Safety. International Labour Organization. pp. 63.34. ISBN 978-92-2-109816-4. OCLC 35279504.
- Haynes, 2011, p. 4.25.
- Rolf Haubrichs, Pierre-Leonard Zaffalon (13 de junio de 2017). «Osmium vs. ‘Ptène’: The Naming of the Densest Metal | Johnson Matthey Technology Review». Johnson Matthey Technology Review (en inglés estadounidense). Consultado el 3 de julio de 2017.
- http://www.lenntech.es/tabla-peiodica/densidad.htm
- Arblaster, J. W. (1989). «Densities of osmium and iridium: recalculations based upon a review of the latest crystallographic data». Platinum Metals Review 33 (1): 14-16.
- Arblaster, J. W. (1995). «Osmium, the Densest Metal Known». Platinum Metals Review 39 (4): 164. Archivado desde el original el 27 de septiembre de 2011. Consultado el 21 de marzo de 2020.
- Weinberger, Michelle; Tolbert, Sarah; Kavner, Abby (2008). «Osmium Metal Studied under High Pressure and Nonhydrostatic Stress». Phys. Rev. Lett. 100 (4): 045506. Bibcode:2008PhRvL.100d5506W. PMID 18352299. doi:10.1103/PhysRevLett.100.045506.
- Cynn, Hyunchae; Klepeis, J. E.; Yeo, C. S.; Young, D. A. (2002). «Osmium has the Lowest Experimentally Determined Compressibility». Physical Review Letters 88 (13): 135701. Bibcode:2002PhRvL..88m5701C. PMID 11955108. doi:10.1103/PhysRevLett.88.135701.
- Sahu, B. R.; Kleinman, L. (2005). «Osmium Is Not Harder Than Diamond». Physical Review B 72 (11): 113106. Bibcode:2005PhRvB..72k3106S. doi:10.1103/PhysRevB.72.113106.
- Stoye, Emma (23 de octubre de 2014). «Iridium forms compound in +9 oxidation state». Royal Society of Chemistry.
- Selig, H.; Claassen, H. H.; Chernick, C. L.; Malm, J. G. et al. (1964). «Xenon tetroxide – Preparation + Some Properties». Science 143 (3612): 1322-3. Bibcode:1964Sci...143.1322S. JSTOR 1713238. PMID 17799234. doi:10.1126/science.143.3612.1322.
- Huston, J. L.; Studier, M. H.; Sloth, E. N. (1964). «Xenon tetroxide – Mass Spectrum». Science 143 (3611): 1162-3. Bibcode:1964Sci...143.1161H. JSTOR 1712675. PMID 17833897. doi:10.1126/science.143.3611.1161-a.
- Barnard, C. F. J. (2004). «Oxidation States of Ruthenium and Osmium». Platinum Metals Review 48 (4): 157. doi:10.1595/147106704X10801.
- «Chemistry of Hassium». Gesellschaft für Schwerionenforschung mbH. 2002. Archivado desde el original el 14 de enero de 2012. Consultado el 31 de enero de 2007.
- Gong, Yu; Zhou, Mingfei; Kaupp, Martin; Riedel, Sebastian (2009). «Formation and Characterization of the Iridium Tetroxide Molecule with Iridium in the Oxidation State +VIII». Angewandte Chemie International Edition 48 (42): 7879-83. PMID 19593837. doi:10.1002/anie.200902733.
- Krause, J.; Siriwardane, Upali; Salupo, Terese A.; Wermer, Joseph R. et al. (1993). «Preparation of [Os3(CO)11]2− and its reactions with Os3(CO)12; structures of [Et4N] [HOs3(CO)11] and H2OsS4(CO)». Journal of Organometallic Chemistry 454 (1–2): 263-271. doi:10.1016/0022-328X(93)83250-Y.
- Carter, Willie J.; Kelland, John W.; Okrasinski, Stanley J.; Warner, Keith E. et al. (1982). «Mononuclear hydrido alkyl carbonyl complexes of osmium and their polynuclear derivatives». Inorganic Chemistry 21 (11): 3955-3960. doi:10.1021/ic00141a019.
- Holleman, A. F.; Wiberg, E.; Wiberg, N. (2001). Inorganic Chemistry (1st edición). Academic Press. ISBN 978-0-12-352651-9. OCLC 47901436.
- Griffith, W. P. (1965). «Osmium and its compounds». Quarterly Reviews, Chemical Society 19 (3): 254-273. doi:10.1039/QR9651900254.
- Subcommittee on Platinum-Group Metals, Committee on Medical and Biologic Effects of Environmental Pollutants, Division of Medical Sciences, Assembly of Life Sciences, National Research Council (1977). Platinum-group metals. National Academy of Sciences. p. 55. ISBN 978-0-309-02640-6.
- Bozzola, John J.; Russell, Lonnie D. (1999). «Specimen Preparation for Transmission Electron Microscopy». Electron microscopy : principles and techniques for biologists. Sudbury, Mass.: Jones and Bartlett. pp. 21-31. ISBN 978-0-7637-0192-5.
- Greenwood, N. N.; Earnshaw, A. (1997). Chemistry of the Elements (2nd edición). Oxford:Butterworth-Heinemann. pp. 1113–1143, 1294. ISBN 978-0-7506-3365-9. OCLC 213025882.
- Gulliver, D. J; Levason, W. (1982). «The chemistry of ruthenium, osmium, rhodium, iridium, palladium and platinum in the higher oxidation states». Coordination Chemistry Reviews 46: 1-127. doi:10.1016/0010-8545(82)85001-7.
- Sykes, A. G. (1992). Advances in Inorganic Chemistry. Academic Press. p. 221. ISBN 978-0-12-023637-4.
- «Osmium».
- Audi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik (2003), «The NUBASE evaluation of nuclear and decay properties», Nuclear Physics A 729: 3-128, Bibcode:2003NuPhA.729....3A, doi:10.1016/j.nuclphysa.2003.11.001.
- Dąbek, Józef; Halas, Stanislaw (2007). «Physical Foundations of Rhenium-Osmium Method – A Review». Geochronometria 27: 23-26. doi:10.2478/v10003-007-0011-4.
- Alvarez, L. W.; Alvarez, W.; Asaro, F.; Michel, H. V. (1980). «Extraterrestrial cause for the Cretaceous–Tertiary extinction». Science 208 (4448): 1095-1108. Bibcode:1980Sci...208.1095A. PMID 17783054. doi:10.1126/science.208.4448.1095. «10.1.1.126.8496».
- Venetskii, S. I. (1974). «Osmium». Metallurgist 18 (2): 155-157. doi:10.1007/BF01132596.
- McDonald, M. (959). «The Platinum of New Granada: Mining and Metallurgy in the Spanish Colonial Empire». Platinum Metals Review 3 (4): 140-145. Archivado desde el original el 9 de junio de 2011. Consultado el 20 de marzo de 2020.
- Juan, J.; de Ulloa, A. (1748). Relación histórica del viage a la América Meridional 1. p. 606.
- Hunt, L. B. (1987). «A History of Iridium». Platinum Metals Review 31 (1): 32-41. Consultado el 15 de marzo de 2012.
- Haubrichs, Rolf; Zaffalon, Pierre-Leonard (2017). «Osmium vs. 'Ptène': The Naming of the Densest Metal». Johnson Matthey Technology Review 61 (3): 190. doi:10.1595/205651317x695631.
- Emsley, J. (2003). «Osmium». Nature's Building Blocks: An A-Z Guide to the Elements. Oxford, England, UK: Oxford University Press. pp. 199–201. ISBN 978-0-19-850340-8.
- Griffith, W. P. (2004). «Bicentenary of Four Platinum Group Metals. Part II: Osmium and iridium – events surrounding their discoveries». Platinum Metals Review 48 (4): 182-189. doi:10.1595/147106704X4844.
- Thomson, T. (1831). A System of Chemistry of Inorganic Bodies. Baldwin & Cradock, London; and William Blackwood, Edinburgh. p. 693.
- Weeks, M. E. (1968). Discovery of the Elements (7 edición). Journal of Chemical Education. pp. 414–418. ISBN 978-0-8486-8579-9. OCLC 23991202.
- Tennant, S. (1804). «On Two Metals, Found in the Black Powder Remaining after the Solution of Platina». Philosophical Transactions of the Royal Society 94: 411-418. JSTOR 107152. doi:10.1098/rstl.1804.0018.
- Smil, Vaclav (2004). Enriching the Earth: Fritz Haber, Carl Bosch, and the Transformation of World Food Production. MIT Press. pp. 80-86. ISBN 978-0-262-69313-4.
- George, Micheal W. «2006 Minerals Yearbook: Platinum-Group Metals». United States Geological Survey USGS. Consultado el 16 de septiembre de 2008.
- Wedepohl, Hans K (1995). «The composition of the continental crust». Geochimica et Cosmochimica Acta 59 (7): 1217-1232. Bibcode:1995GeCoA..59.1217W. doi:10.1016/0016-7037(95)00038-2.
- Xiao, Z.; Laplante, A. R. (2004). «Characterizing and recovering the platinum group minerals—a review». Minerals Engineering 17 (9–10): 961-979. doi:10.1016/j.mineng.2004.04.001.
- Seymour, R. J.; O'Farrelly, J. I. (2001). «Platinum-group metals». Kirk Othmer Encyclopedia of Chemical Technology. Wiley. ISBN 978-0471238966. doi:10.1002/0471238961.1612012019052513.a01.pub2.
- «Commodity Report: Platinum-Group Metals». United States Geological Survey USGS. Consultado el 16 de septiembre de 2008.
- George, M. W. (2008). «Platinum-group metals». U.S. Geological Survey Mineral Commodity Summaries.
- George, M. W. 2006 Minerals Yearbook: Platinum-Group Metals. United States Geological Survey USGS. Consultado el 16 de septiembre de 2008.
- Renner, H.; Schlamp, G.; Kleinwächter, I.; Drost, E. et al. (2002). «Platinum group metals and compounds». Ullmann's Encyclopedia of Industrial Chemistry. Wiley. ISBN 978-3527306732. doi:10.1002/14356007.a21_075.
- Gilchrist, Raleigh (1943). «The Platinum Metals». Chemical Reviews 32 (3): 277-372. doi:10.1021/cr60103a002.
- Hunt, L. B.; Lever, F. M. (1969). «Platinum Metals: A Survey of Productive Resources to industrial Uses». Platinum Metals Review 13 (4): 126-138. Consultado el 2 de octubre de 2008.
- Smith, Ivan C.; Carson, Bonnie L.; Ferguson, Thomas L. (1974). «Osmium: An Appraisal of Environmental Exposure». Environmental Health Perspectives 8: 201-213. JSTOR 3428200. PMC 1474945. PMID 4470919. doi:10.2307/3428200.
- «Platinum-Group Metals». USGS. Consultado el 27 de mayo de 2013.
- Linton, Roger C.; Kamenetzky, Rachel R. (1992). «Second LDEF post-retrieval symposium interim results of experiment A0034». NASA. Consultado el 6 de junio de 2009.
- Linton, Roger C.; Kamenetzky, Rachel R.; Reynolds, John M.; Burris, Charles L. (1992). «LDEF experiment A0034: Atomic oxygen stimulated outgassing». NASA. Langley Research Center: 763. Bibcode:1992ldef.symp..763L.
- Cramer, Stephen D.; Covino, Bernard S. Jr. (2005). ASM Handbook Volume 13B. Corrosion: Materials. ASM International. ISBN 978-0-87170-707-9.
- MacDonell, Herbert L. (1960). «The Use of Hydrogen Fluoride in the Development of Latent Fingerprints Found on Glass Surfaces». The Journal of Criminal Law, Criminology, and Police Science 51 (4): 465-470. JSTOR 1140672. doi:10.2307/1140672.
- Chadwick, D. (2002). Role of the sarcoplasmic reticulum in smooth muscle. John Wiley and Sons. pp. 259–264. ISBN 978-0-470-84479-3.
- http://www.quimicaorganica.org/alquenos-reacciones-teoria/dihidroxilacion-alquenos.html
- Kolb, H. C.; Van Nieuwenhze, M. S.; Sharpless, K. B. (1994). «Catalytic Asymmetric Dihydroxylation». Chemical Reviews 94 (8): 2483-2547. doi:10.1021/cr00032a009.
- Colacot, T. J. (2002). «2001 Nobel Prize in Chemistry». Platinum Metals Review 46 (2): 82-83.
- Bowers, B., B. (2001). «Scanning our past from London: the filament lamp and new materials». Proceedings of the IEEE 89 (3): 413-415. doi:10.1109/5.915382.
- Antonov, V. E.; Belash, I. T.; Malyshev, V. Yu.; Ponyatovsky, E. G. (1984). «The Solubility of Hydrogen in the Platinum Metals under High Pressure». Platinum Metals Review 28 (4): 158-163.
- Torr, Marsha R. (1985). «Osmium coated diffraction grating in the Space Shuttle environment: performance». Applied Optics 24 (18): 2959. Bibcode:1985ApOpt..24.2959T. PMID 18223987. doi:10.1364/AO.24.002959.
- Gull, T. R.; Herzig, H.; Osantowski, J. F.; Toft, A. R. (1985). «Low earth orbit environmental effects on osmium and related optical thin-film coatings». Applied Optics 24 (16): 2660. Bibcode:1985ApOpt..24.2660G. PMID 18223936. doi:10.1364/AO.24.002660.
- Sheppeard, H.; D. J. Ward (1980). «Intra-articular osmic acid in rheumatoid arthritis: five years' experience». Rheumatology 19 (1): 25-29. PMID 7361025. doi:10.1093/rheumatology/19.1.25.
- Lau, T.-C; W.-X. Ni; W.-L. Man; M. T.-W. Cheung et al. (2011). «Osmium(vi) complexes as a new class of potential anti-cancer agents». Chem. Commun. 47 (7): 2140-2142. PMID 21203649. doi:10.1039/C0CC04515B.
- Sadler, Peter; Steve D. Shnyder; Ying Fu; Abraha Habtemariam et al. (2011). «Anti-colorectal cancer activity of an organometallic osmium arene azopyridine complex». Med. Chem. Commun. 2 (7): 666-668. doi:10.1039/C1MD00075F.
- Fu, Ying; Romero, María J.; Habtemariam, Abraha et al. (2012). «The contrasting chemical reactivity of potent isoelectronic iminopyridine and azopyridine osmium(II) arene anticancer complexes». Chemical Science 3 (8): 2485-2494. doi:10.1039/C2SC20220D.
Bibliografía
- Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd edición). CRC Press. ISBN 978-1439855119. Parámetro desconocido
|title-link=ignorado (ayuda)
Enlaces externos
 Wikimedia Commons alberga una categoría multimedia sobre osmio.
Wikimedia Commons alberga una categoría multimedia sobre osmio.
En inglés
- WebElements.com - Osmium
- EnvironmentalChemistry.com - Osmium
- Pubchem - Osmium
- FLEGENHEIMER, J. (2014). The mystery of the disappearing isotope. Revista Virtual de Química, V. XX. Available at https://web.archive.org/web/20150619170958/http://www.uff.br/RVQ/index.php/rvq/article/viewFile/660/450