Francio
El francio, antiguamente conocido como eka-cesio y actinio K,[1] es un elemento químico cuyo símbolo es Fr y su número atómico es 87. Su electronegatividad es la más baja conocida y es el segundo elemento menos abundante en la naturaleza (el primero es el astato). El francio es un metal alcalino altamente radiactivo y reactivo que se desintegra generando astato, radio y radón. Como el resto de los metales alcalinos, solo posee un electrón en su capa de valencia.
| Radón ← Francio → Radio | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tabla completa • Tabla ampliada | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Información general | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | Francio, Fr, 87 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie química | Metales alcalinos | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 1, 7, s | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atómica | 223 u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [Rn]7s1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza Mohs | Sin datos | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrones por nivel | 2, 8, 18, 32, 18, 8, 1 (imagen) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio medio | Sin datos pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividad |
0,7 (Pauling) 0,9 (Allred y Rochow) (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio atómico (calc) | 270 pm (radio de Bohr) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio iónico | 194 pm (Fr+, hexacoordinado) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 260 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio de van der Waals | 348 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado(s) de oxidación | 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Óxido | Base fuerte | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1.ª energía de ionización | 380 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado ordinario | Líquido | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad | 1870 kg/m3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusión | 300 K (27 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullición | 950 K (677 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de vaporización | 65 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de fusión | 2 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Presión de vapor | Sin datos | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Varios | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | Cúbica centrada en el cuerpo | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor específico | Sin datos J/(K·kg) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad eléctrica | 3 × 106/m O S/m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 15 W/(K·m) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidad del sonido | Sin datos m/s a 293,15 K (20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isótopos más estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Isótopos del francio | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Valores en el SI y condiciones normales de presión y temperatura, salvo que se indique lo contrario. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

Marguerite Perey descubrió este elemento en 1939. El francio fue el último elemento químico descubierto en la naturaleza antes de ser sintetizado.[2] Fuera del laboratorio, el francio es extremadamente escaso, encontrándose en trazas en menas de uranio y de torio, donde el 223Fr está continuamente formándose y desintegrándose. La cantidad de 223Fr en la corteza terrestre en un momento dado posiblemente no exceda los 30 gramos; el resto de los isótopos son sintéticos. La mayor cantidad recuperada de cualquiera de sus isótopos fue un clúster de 10 000 millones de átomos (de 210Fr) sintetizado como un gas ultra frío en Stony Brook en 1996.[3]
Propiedades físicas y químicas
El francio es menos estable que cualquier otro elemento más ligero que el nobelio (elemento 102);[3] su isótopo más estable, el 223Fr, posee un período de semidesintegración menor de 22 minutos. El astato, que es el siguiente elemento menos estable, tiene período de semidesintegración máximo de 8,5 horas.[4] Todos los isótopos del francio se desintegran generando astato, radio y radón.[4]
El francio es un metal alcalino cuyas propiedades químicas son semejantes a las del cesio.[3] Puesto que es un elemento muy pesado con un solo electrón de valencia,[5] posee el mayor peso equivalente de todos los elementos químicos.[3] El francio tiene la más baja electronegatividad de todos los elementos conocidos, con un valor de 0,7 en la escala de Pauling.[6] Le sigue el cesio con un valor de 0,79.[7] El francio líquido, en el supuesto de poder ser obtenido, tendría una tensión superficial de 0,05092 J·m–2 en el punto de fusión.[8]
El francio coprecipita, junto con muchas sales de cesio, como el perclorato de cesio, formando pequeñas cantidades de perclorato de francio. Esta coprecipitación puede emplearse para aislar el francio, adaptando el método de precipitación del radiocesio de Glendenin y Nelson. También coprecipita con otras sales de cesio como el yodato, el picrato, el tartrato (también con el tartrato de rubidio), el cloroplatinato y el silicowolframato. Otras coprecipitaciones se producen con el ácido silicowolfrámico y con el ácido perclórico, sin necesidad de que otro metal alcalino esté presente como portador, lo que posibilita otros métodos de separación para el francio.[9][10] Casi todas las sales de francio son solubles en agua.[11]
Aplicaciones del francio
No hay aplicaciones comerciales para el francio debido a su escasez y a su inestabilidad.[12][13][14][15][16] Solo ha sido usado en tareas de investigación, tanto en el campo de la biología como en el de la estructura atómica. Se pensó que el francio podría servir de ayuda para el diagnóstico de enfermedades relacionadas con el cáncer;[4] sin embargo, finalmente esta aplicación se ha considerado impracticable.[14]
La capacidad para sintetizar el francio, atraparlo y enfriarlo, junto con su estructura atómica relativamente simple, lo han convertido en sujeto de experimentación en espectroscopia especializada. Estos experimentos han conducido a la obtención de información más específica sobre los niveles energéticos y las constantes de acoplamiento entre partículas subatómicas.[17] Estudios realizados sobre la luz emitida por iones de 210Fr atrapados por láser han arrojado datos precisos sobre las transiciones entre niveles energéticos atómicos. Se ha comprobado que estos resultados experimentales son bastante parecidos a los que predice la Teoría Cuántica.[18]
Historia
Ya en 1870, los químicos pensaban que debía existir un metal alcalino más allá del cesio, con un número atómico de 87.[4] Se le denominaba con el nombre provisional de eka-cesio.[19] Algunos equipos de investigación intentaron localizar y aislar el elemento en cuestión y se tiene constancia de al menos cuatro anuncios públicos falsos que proclamaban haber descubierto dicho elemento antes de que fuera realmente descubierto.
Descubrimientos erróneos e incompletos
El químico ruso D. K. Dobroserdov fue el primer científico que aseguró haber descubierto eka-cesio. En 1925, observó una débil radiactividad en una muestra de potasio, otro metal alcalino, y concluyó que el eka-cesio contaminaba la muestra.[20] Publicó una tesis sobre sus predicciones de las propiedades del eka-cesio, en la que nombraba al elemento con el nombre de russio, en honor a su país de procedencia.[21] Poco tiempo después, empezó a centrarse en su carrera docente en el Instituto Politécnico de Odessa, abandonando por completo sus esfuerzos por aislar el eka-cesio.[20]
Al año siguiente, en 1926, los químicos ingleses Gerald J. F. Druce y Frederick H. Loring analizaron una radiografía de rayos X del sulfato de manganeso (II).[21] Observaron líneas espectrales que creyeron pertenecientes al eka-cesio. Anunciaron el descubrimiento del elemento 87 y propusieron el nombre de alcalinio para el que sería el metal alcalino más pesado.[20]
En 1930, el profesor Fred Allison del Instituto Politécnico de Alabama anunció haber descubierto el elemento 87 analizando polucita y lepidolita usando su máquina magneto - óptica. Allison propuso que fuera bautizado como virginio, en honor a su estado natal, Virginia, así como que se usaran los símbolos Vi y Vm.[21][22] En 1934, sin embargo, el profesor MacPherson de la UC Berkeley desautorizó la efectividad del dispositivo de Allison y la validez de su falso descubrimiento.[23]
En 1936, el químico rumano Horia Hulubei y su colega francesa Yvette Cauchois analizaron también la polucita, esta vez usando su aparato de rayos X de alta resolución.[20] Observaron varias líneas de emisión débiles que supusieron que sería debidas al elemento 87. Hulubei y Cauchois anunciaron su descubrimiento y propusieron el nombre de moldavio, con el símbolo Ml, en honor a Moldavia, la provincia rumana, actualmente independiente, donde llevaron a cabo su trabajo.[21] En 1937, el trabajo de Hulubei fue criticado por el físico americano F. H. Hirsh Jr., que rechazó los métodos de investigación del químico rumano. Hirsh estaba convencido de que el eka-cesio no podría ser encontrado en la naturaleza, y que las líneas que había observado Hulubei eran debidas al mercurio o al bismuto. El químico rumano, sin embargo, insistió en que su aparato de rayos X y sus métodos eran demasiado precisos como para cometer tales errores. Jean Baptiste Perrin, ganador del premio Nobel y mentor de Hulubei, apoyó al moldavio como el verdadero eka-cesio en lugar del recién descubierto francio de Marguerite Perey. Perey, sin embargo, criticó de manera continua el trabajo de Hulubei hasta que ella fue acreditada como la única descubridora del elemento 87.[20]
Análisis de Perey
El eka-cesio fue realmente descubierto en 1939 por Marguerite Perey, del Instituto Curie de París (Francia), cuando purificó una muestra de 227Ac que poseía una energía de desintegración de 220 keV. Sin embargo, Perey advirtió en la desintegración partículas con un nivel energético por debajo de los 80 keV. Pensó que esta actividad debía ser causada por un producto previo de desintegración no identificado, un producto separado durante la purificación, pero que volvía a emerger del 227Ac puro. Varias pruebas eliminaron la posibilidad de que se fuera de torio, radio, plomo, bismuto o talio, tratándose por tanto de un elemento desconocido. El nuevo producto mostraba propiedades químicas propias de un metal alcalino (tal como la coprecipitación con las sales de cesio), lo que llevó a Perey a pensar que se encontraba frente al elemento 87, generado por la desintegración alfa del 227Ac.[19] Perey intentó entonces determinar la proporción entre la desintegración beta y la desintegración alfa del 227Ac. Su primera prueba indicaba que la desintegración alfa alcanzaba el 0.6%, resultado que fue revisado hasta llegar al valor de un 1%.[24]
Perey nombró al nuevo isótopo como actinio K, que se refería a lo que ahora conocemos como 223Fr,[19] y en 1946, propuso el nombre de catio para su recién descubierto elemento, ya que creía que era el catión más electropositivo de todos los elementos químicos. Irène Joliot-Curie, una de las supervisoras de Perey, se opuso a ese nombre pues parecía hacer más referencia a "cat" (gato en inglés) que a catión.[19] Entonces Perey sugirió el nombre de francio como homenaje al país donde lo descubrió. Este nombre fue oficialmente adoptado por la Unión Internacional de Químicos en 1949,[4] y se le asignó el símbolo Fa, pero esta abreviatura fue cambiada por Fr poco después.[25] El francio es el último de los elementos que se encuentran en la naturaleza en ser descubierto, siendo el anterior el renio, en 1925.[19] Posteriores investigaciones sobre la estructura del francio fueron llevadas a cabo por Sylvain Lieberman y su equipo en el CERN en los años 70 y 80, entre otros.[26]
Abundancia

Natural
El 223Fr resulta de la desintegración alfa del 227Ac y puede encontrarse en trazas en los minerales de uranio y de torio.[3] En una muestra de uranio, se estima que hay solo un átomo de francio por cada 1×1018 átomos de uranio.[14][27] Después del astato, el francio es el elemento menos abundante en la corteza terrestre.[4][14]
Sintetizado
El francio puede sintetizarse en la reacción nuclear:
- 197Au + 18O → 210Fr + 5n.
Este proceso, desarrollado por Stony Brook Physics, genera isótopos de francio con masas 209, 210 y 211,[28] que pueden aislarse en una trampa magneto-óptica (MOT).[29] La tasa de producción de un isótopo en particular depende en la energía del haz de oxígeno. El haz del Stony Brook LINAC produce 210Fr en el objetivo de oro con la reacción nuclear 197Au + 18O → 210Fr + 5n. La producción requiere de algún tiempo para desarrollarse y entenderse. Esto es crítico para operar el objetivo oro muy cercano de su punto de fusión y para asegurarse de que su superficie esté muy limpia. La reacción nuclear incrusta de manera profunda los átomos de francio con el objetivo de oro, y se debe quitar de manera eficiente. Los átomos se difunden rápidamente en la superficie del objetivo de oro y se liberan en forma de iones, sin embargo, esto no sucede todo el tiempo. Los iones de francio son guiados por las lentes electrostáticas hasta que aterrizan en una superficie de itrio caliente y se convierten en neutrales otra vez. Entonces el francio se inyecta en una ampolla de vidrio. Los rayos láser y un campo magnético enfrían y confinan a los átomos. Aunque los átomos permanezcan en la trampa de solo unos 20 segundos antes de que escapen (o se descompongan), un flujo constante de átomos frescos reemplaza a los perdidos, manteniendo el número de átomos atrapados aproximadamente constantes durante varios minutos o más tiempo. Inicialmente, fueron atrapados alrededor de 1000 átomos de francio en el experimento. Esto fue gradualmente mejorado y la instalación es capaz de atrapar más de 300.000 átomos neutros de francio la vez.[30] Aunque se trata de átomos neutrales "metálicos" ("metales francios"), están en un estado que no se considera gaseoso. Se atrapa el suficiente Francio que la luz emitida por los átomos puede ser capturada por una cámara de video, ya que son fluorescentes. Los átomos aparecen como una esfera brillante alrededor de 1 milímetro de diámetro. Esta fue la primera vez que alguien vio francio. Los investigadores ahora pueden hacer mediciones muy sensibles de la luz emitida y absorbida por los átomos atrapados, proporcionando así los primeros resultados experimentales sobre diversas transiciones entre niveles de energía atómica en francios. Las mediciones iniciales muestran muy buen acuerdo entre los valores experimentales y los cálculos basados en la teoría cuántica. Otros métodos de síntesis incluyen bombardear radio con neutrones, y bombardear torio con protones, deuterones o iones de helio.[24] El francio no ha sido, y probablemente no será, sintetizado en cantidades lo suficientemente grandes como para ser pesado.[4][31][14]
Isótopos
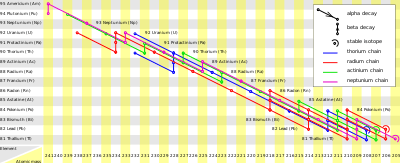
Se conocen 34 isótopos del francio que comprenden un rango de masas atómicas desde 199 hasta 232.[32] El francio posee siete isómeros nucleares metaestables.[3] El 223Fr y el 221Fr son los únicos isótopos que se presentan en la naturaleza, aunque el primero es mucho más común que el segundo.[33]
El 223Fr es el isótopo más estable con un periodo de semidesintegración de 21,8 minutos,[3] y es bastante improbable que alguna vez se descubra o sintetice un isótopo de francio con un periodo mayor.[24] El 223Fr es el quinto producto de la serie de desintegración del actinio, procedente del 227Ac.[34] El 223Fr se desintegra después para generar 223Ra por desintegración beta (energía de desintegración: 1149 keV), con una ruta menor (0,006%) de desintegración alfa que genera 219At (energía de desintegración: 5,4 MeV).[35]
El 221Fr posee un periodo de semidesintegración de 4,8 minutos.[3] Es el noveno producto de la serie de desintegración del plutonio, procedente del 225Ac.[16] El 221Fr se desintegra después para generar 217At por desintegración alfa (energía de desintegración: 6,457 MeV).[3]
El isótopo en estado fundamental menos estable es el 215Fr, con un periodo de semidesintegración de 0,12 μs (energía de desintegración hasta 211At: 9,54 MeV).[3] Su isómero metaestable, el 215mFr, es aún menos estable, con un periodo de semidesintegración de 3,5 ns.[36]
Referencias
- En realidad, el isótopo menos estable 223Fr.
- Algunos elementos sintéticos, como el tecnecio, fueron hallados después en formal natural.
- CRC Handbook of Chemistry and Physics. Volumen 4. Página 12. 2006. CRC. ISBN 0-8493-0474-1
- Price, Andy. «Francio». Consultado el 25 de marzo de 2007.
- Winter, Mark. «Electron Configuration». En Universidad de Sheffield, ed. Francium. Consultado el 18 de abril de 2007.
- Pauling, Linus (1960). The Nature of the Chemical Bond (3rd Edn.). Cornell University Press. p. 93.
- Winter, Mark. «Electronegatividades». En Universidad de Sheffield, ed. Cesio. Consultado el 9 de mayo de 2007. Pauling asigna al cesio y al francio los mismos valores de electronegatividad.
- Kozhitov, L. V.; Kol'tsov, V. B., and Kol'tsov, A. V. (21 de febrero de 2003). «Evaluation of the Surface Tension of Liquid Francium». Inorganic Materials (Springer Science & Business Media B.V.) 39 (11): 1138-1141. Consultado el 14 de abril de 2007.
- E. K. Hyde. Radiochemical Methods for the Isolation of Element 87 (Francium). J. Am. Chem. Soc. 1952, 74, 4181-4184..
- E. N K. Hyde Radiochemistry of Francium,Subcommittee on Radiochemistry, National Academy of Sciences-National Research Council; available from the Office of Technical Services, Dept. of Commerce, 1960.
- A. G. Maddock. Radioactivity of the heavy elements. Q. Rev., Chem. Soc., 1951, 3, 270–314. doi 10.1039/QR9510500270
- Winter, Mark. «Uses». Francium. The University of Sheffield. Consultado el 25 de marzo de 2007.
- Bentor, Yinon. «Chemical Element.com - Francium». Consultado el 25 de marzo de 2007.
- Emsley, John (2001). Nature's Building Blocks. Oxford: Oxford University Press. pp. 151-153. 0-19-850341-5.
- Gagnon, Steve. «Francium». Jefferson Science Associates, LLC. Consultado el 1 de abril de 2007.
- Considine, Glenn D., ed. (2005), "Chemical Elements", Van Nostrand's Encyclopedia of Chemistry, New York: Wylie-Interscience, 0-471-61525-0, at 332
- Gomez, E; Orozco, L A, and Sprouse, G D (7 de noviembre de 2005). «Spectroscopy with trapped francium: advances and perspectives for weak interaction studies». Rep. Prog. Phys. 69 (1): 79-118. doi:10.1088/0034-4885/69/1/R02. Consultado el 11 de abril de 2007.
- Peterson, I (11 de mayo de 1996). Creating, cooling, trapping francium atoms. Science News. p. 294. Consultado el 11 de abril de 2007.
- Adloff, Jean-Pierre; Kaufman, George B. (2005-09-25). Francium (Atomic Number 87), the Last Discovered Natural Element. The Chemical Educator 10 (5). Consultado el 2007-03-26.
- Fontani, Marco (2005-09-10). "The Twilight of the Naturally-Occurring Elements: Moldavium (Ml), Sequanium (Sq) and Dor (Do)". International Conference on the History of Chemistry: 1–8. Consultado el 2007-04-08.
- Van der Krogt, Peter (1 de octubre de 2006). «Francium». Elementymology & Elements Multidict. Consultado el 8 de abril de 2007.
- Alabamine & Virginium. TIME. 15 de febrero de 1932. Consultado el 4 de enero de 2007.
- MacPherson, H. G. (21 de diciembre de 1934). «An Investigation of the Magneto-Optic Method of Chemical Analysis». Physical Review (American Physical Society) 47 (4): 310-315. doi:10.1103/PhysRev.47.310. Consultado el 8 de abril de 2007.
- McGraw-Hill Encyclopedia of Science & Technology 7. McGraw-Hill Professional. 2002. pp. 493–494. ISBN 0-07-913665-6.
- Grant, Julius (1969), "Francium", Hackh's Chemical Dictionary, McGraw-Hill, p. 279–280
- «History». Francium. SUNY Stony Brook Physics & Astronomy. 20 de febrero de 2007. Archivado desde el original el 5 de abril de 2007. Consultado el 26 de marzo de 2007.
- Winter, Mark. «Geological information». Francium. The University of Sheffield. Consultado el 26 de marzo de 2007.
- «Production of Francium». Francium. SUNY Stony Brook Physics & Astronomy. 20 de febrero de 2007. Archivado desde el original el 5 de abril de 2007. Consultado el 26 de marzo de 2007.
- «Cooling and Trapping». Francium. SUNY Stony Brook Physics & Astronomy. 20 de febrero de 2007. Archivado desde el original el 5 de abril de 2007. Consultado el 1 de mayo de 2007.
- Luis A. Orozco (2003). «Francium». Chemical and Engineering News.
- «Francium» (en inglés). Los Alamos National Laboratory. 15 de diciembre. Consultado el 19 de febrero de 2012.
- Lide, David R., ed. (2006), CRC Handbook of Chemistry and Physics 11, CRC, pp. 180-181, 0-8493-0487-3.
- Considine, Glenn D., ed. (2005), "Francium", Van Nostrand's Encyclopedia of Chemistry, New York: Wylie-Interscience, 0-471-61525-0, p. 679
- Considine, Glenn D., ed. (2005), «Chemical Elements», Van Nostrand's Encyclopedia of Chemistry, New York: Wylie-Interscience, p. 332, 0-471-61525-0.
- National Nuclear Data Center (1990). «Table of Isotopes decay data». Brookhaven National Laboratory. Archivado desde el original el 31 de octubre de 2006. Consultado el 4 de abril de 2007.
- National Nuclear Data Center (2003). «Fr Isotopes». Brookhaven National Laboratory. Archivado desde el original el 30 de junio de 2007. Consultado el 4 de abril de 2007.
Bibliografía
- Pearson, Addison-Wesley (1999). Química para el nuevo milenio. México: Prentice-Hall. ISBN 970-17-0341-3.
- Lembrino Pérez, Imelda Luz (2006). Química I. Thomson Learning Ibero. ISBN 970-686-640-X.
- Ferrer Soria, Antonio (2006). Física nuclear y de partículas. Publ. Universitat de Valencia. ISBN 84-370-6568-2.
- Rosales Guzmán, Elizabeth (2005). Química 1 para Bachillerato. LIMUSA Noriega Editores. ISBN 968-18-6632-0.
- Baldor, F. J. (1976). Nomenclatura química inorgánica. SELECTOR. ISBN 968-403-131-9.
Enlaces externos
 Wikimedia Commons alberga una galería multimedia sobre Francio.
Wikimedia Commons alberga una galería multimedia sobre Francio.
 Wikcionario tiene definiciones y otra información sobre [[wikt::francio|francio]].
Wikcionario tiene definiciones y otra información sobre [[wikt::francio|francio]].- WebElements.com - Francium
- Chemical information for Francium
- EnvironmentalChemistry.com - Francium