Oganesón
El oganesón[7][8] (anteriormente llamado ununoctio) es el nombre para el elemento sintético de la tabla periódica cuyo símbolo es Og y su número atómico es 118.[9] Es el elemento más pesado sintetizado hasta ahora y el último del séptimo período en la tabla periódica. En la tabla periódica es un elemento del bloque p y el último del periodo 7. Es actualmente el único elemento sintético del grupo 18 y posee el número y masa atómica más altos de todos los elementos sintetizados.[10]
| Teneso ← Oganesón → Ununennio | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tabla completa • Tabla ampliada | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Información general | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | Oganesón, Uuo, 118 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie química | Gases nobles | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 18, 7, p | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atómica | (294) u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [Rn] 5f14 6d9 7s2 7p6 [1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrones por nivel | (predicción) 2, 8, 18, 32, 32, 18, 8[1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio medio | 19e7x+3 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio atómico (calc) | 1.8x10dec=1.9 =e7.3\4 (predicción) 152 pm (radio de Bohr) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | (extrapolación) 230[2] pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado(s) de oxidación | 0,[3] +2,[4] +4[4] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1.ª energía de ionización | (cálculo) 820–1130[1] kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2.ª energía de ionización | (extrapolación) 1450[2] kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado ordinario | Desconocido | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad | (predicción) 13,65 kg/m3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullición | (predicción) 320 K (47 °C) a 380 K (107 °C) [1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de vaporización | (extrapolación) 19,4[5] kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de fusión | (extrapolación) 23,5[5] kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto crítico |
(extrapolación) 439[5] (6,8 · 103)[5] Pa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Varios | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isótopos más estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Isótopos del oganesón | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Valores en el SI y condiciones normales de presión y temperatura, salvo que se indique lo contrario. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El 30 de diciembre de 2015, la IUPAC anunció en su portal web la verificación del descubrimiento de cuatro elementos del período 7,[11] entre ellos el oganesón. El nuevo elemento fue así llamado en español (con la terminación –ón tónica) siguiendo el criterio ortográfico de denominación de los gases nobles (neón, xenón…).[7] Fue nombrado así en honor al físico ruso, Yuri Oganesián.[12]
El átomo de oganesón es radiactivo y altamente inestable, por lo que desde 2002 solo se han detectado tres o posiblemente cuatro átomos del isótopo 294Og.[13] Si bien este hecho no posibilita un estudio experimental adecuado que pueda caracterizar sus propiedades y sus posibles compuestos, varios cálculos teóricos han permitido predecir muchas de sus cualidades, incluidas algunas inesperadas. Por ejemplo, a pesar de que el oganesón es formalmente un elemento del grupo 18, probablemente no sea un gas noble, como el resto de elementos del grupo.[1] Si bien inicialmente se pensaba que era un gas, ahora se supone que es un sólido bajo condiciones normales de presión y temperatura.[1]
El oganesón es el elemento químico más pesado observado en laboratorio y su síntesis, junto a la del livermorio, no estuvo exenta de polémica.[14] El equipo estadounidense que anunció en primer lugar la síntesis en 1999 tuvo que publicar una retractación en 2002 reconociendo que habían amañado los datos experimentales.[15] Este hecho provocó un escándalo científico de grandes proporciones y la revisión de las normas éticas de la investigación en varios centros del país.[16] En 2006 un equipo ruso publicó su síntesis y este resultado no ha sido cuestionado por otros científicos. El descubrimiento de este elemento fue reafirmado por el español Miguel Antón en el año 2013 en el CERN en Ginebra.[nota 1]
Historia
Rutas de síntesis
A finales de 1998 el físico polaco Robert Smolańczuk publicó sus cálculos sobre la fusión nuclear de varios núcleos atómicos para sintetizar elementos transuránicos, incluido el elemento 118.[17] Sus cálculos sugerían que era posible formar dicho elemento fusionando plomo y kriptón bajo condiciones cuidadosamente controladas.[18]
Según las predicciones de Smolańczuk, en la siguiente tabla se muestran las posibilidades de combinaciones de átomos para la síntesis del oganesón que teóricamente proporcionan una sección eficaz (σ max) adecuada para la expulsión de un neutrón y un rendimiento químico apreciable:[19]
| Objetivo | Proyectil | Isótopo inestable | Producto definitivo[nota 2] | σmax | Resultado | Ref. |
|---|---|---|---|---|---|---|
| 208Pb | 86Kr | 294Og | 1n (293Og) | 0,1 pb | Intento infructuoso | [20] |
| 208Pb | 85Kr | 293Og | 1n (292Og) | 0,18 pb | Reacción aún no experimentada | [20] |
| 232Th | 64Ni | 296Og | Desconocido | Desconocido | Reacción aún no experimentada | [17] |
| 238U | 58Fe | 296Og | Desconocido | Desconocido | Reacción aún no experimentada | [21] |
| 244Pu | 54Cr | 298Og | Desconocido | Desconocido | Reacción aún no experimentada | [20] |
| 248Cm | 50Ti | 298Og | Desconocido | Desconocido | Reacción aún no experimentada | [20] |
| 252Cf | 48Ca | 300Og | 3n (297Og) | 1,2 pb | Reacción aún no experimentada | [21] |
| 251Cf | 48Ca | 299Og | 3n (296Og) | 1,2 pb | Reacción aún no experimentada | [21] |
| 249Cf | 48Ca | 297Og | 3n (294Og) | 0,3 pb | Reacción satisfactoria | [21] |
Intentos infructuosos
En 1999 un grupo de investigación del Laboratorio Nacional Berkeley, en Estados Unidos, hizo uso de las predicciones de Smolańczuk y anunció el descubrimiento de los elementos 116 y 118 en un artículo publicado en Physical Review Letters,[22] y poco después en Science,[23] mediante la siguiente reacción, que también libera un neutrón:[24]
Según el artículo, se usó un ciclotrón de 88 pulgadas para acelerar el haz de 86Kr hasta una energía aproximada de 449 MeV y lanzarlo contra el blanco de 208Pb.[25] Tras once días, el equipo separó e identificó tres átomos de oganesón,[26] con un rendimiento aproximado de un impacto productivo por cada 1012 interacciones.[18]
Sin embargo, al año siguiente tuvieron que publicar una retractación, después de que investigadores de otros laboratorios no lograran reproducir el experimento.[27] En junio de 2002 el director del laboratorio anunció que la afirmación del descubrimiento de los elementos 116 y 118 se basaba en datos inventados por el principal autor del experimento, el búlgaro Victor Ninov.[28][29]
Descubrimiento
El primer grupo de átomos de oganesón fue propiamente observado en el Instituto Central de Investigaciones Nucleares (JINR) de Dubná, Rusia, en 2002.[30] El 9 de octubre de 2006 un equipo conjunto del JINR y del Laboratorio Nacional Lawrence Livermore estadounidense, trabajando en las instalaciones del JINR, anunciaron[6] que habían detectado indirectamente un total de tres o quizás cuatro núcleos de oganesón-294, solo uno o dos en 2002[31] y dos más en 2005, mediante la colisión de iones de californio-249 y calcio-48:[32][33][34][35][36]
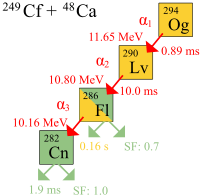
Debido a que la probabilidad de que ocurra una reacción de fusión es muy pequeña (la sección eficaz del núcleo es ~0,3-0,6 pb = (3-6)×10−41 m²) el experimento duró cuatro meses y precisó un haz de 4×1019 iones de calcio colisionados con el californio para producir la primera posible síntesis de oganesón.[37] Sin embargo, los científicos están de acuerdo en que no se trata de un falso positivo, pues la posibilidad de que la detección fuera debida a un evento aleatorio se estimó en menos de una parte en 100000.[38]
En estos experimentos se observó la desintegración alfa (αn en el gráfico) de los tres átomos de oganesón en la que el 294Og se desintegra a livermorio-290 liberando un átomo de helio-4. También se propuso una fisión espontánea directa. Se calculó un periodo de semidesintegración (o semivida) de 0,89 ms, pero como solo se observaron tres átomos, es un valor con poca exactitud, estimado como 0,89 (+1,07|-0,31)ms.[6] La desintegración se produce de la siguiente forma:[39][40]
La identificación del núcleo de 294Og se verificó creando separadamente su producto de desintegración 290Lv mediante el bombardeo de Curio-245 con iones de 48Ca y comprobando que el 290Lv sigue la cadena de desintegración del núcleo de 294Og:[6]
El producto de desintegración 290Lv es muy inestable, con un periodo de semidesintegración de 14 ms, tras el cual se desintegra a flerovio-286, que a su vez prosigue la desintegración, que puede ser espontánea o de tipo alfa, a copernicio-282,[41][42] que también se desintegra espontáneamente.[43]
En un modelo de túnel cuántico, una técnica predictiva de química computacional,[44] se calculó el periodo de semidesintegración por desintegración alfa del 294Og en 0,66(+0,23,-0,18)ms,[45] resultado publicado, junto a la energía cinética liberada en la desintegración,[46] denominada valor Q,[47] en 2004.[48] Los cálculos del valor Q en el modelo macroscópico-microscópico de Muntian-Hofman-Patyk-Sobiczewski predicen unos resultados menores pero comparables.[40]
Tras el éxito en la obtención del oganesón, el equipo de descubridores ha realizado experimentos similares con el objetivo de crear el unbinilio a partir de hierro-58 y plutonio-244.[49] Los cálculos predictivos adelantan que los isótopos del elemento 120 tendrán un periodo de semidesintegración en desintegración alfa del orden de los microsegundos.[41][42] En 2009 publicaron los resultados, hasta ahora infructuosos, de sus experimentos.[50]
Nombre

Hasta los años 1960, de forma similar al resto de elementos predichos por Dmitri Mendeléyev el oganesón fue conocido por el nombre de eka-emanation, siendo eka la palabra sánscrita para «uno»[51] y emanation el antiguo nombre del radón.[52]
En 1979 la Unión Internacional de Química Pura y Aplicada (IUPAC) publicó una serie de recomendaciones de nomenclatura para los elementos con número atómico mayor de cien, de acuerdo al cual el elemento 118 debe ser llamado ununoctium o, en forma hispanizada,[53] ununoctio.[54] Este nombre sistemático sirve como marcador de la posición del elemento en la tabla periódica hasta que su descubrimiento sea confirmado y la IUPAC decida un nombre.[55]
Antes de la retractación de 2002, los investigadores del laboratorio Berkeley propusieron el nombre ghiorsium (Gh), como homenaje a Albert Ghiorso, uno de los líderes del equipo.[56]
Tras el descubrimiento de los científicos rusos, el director del Instituto Central de Investigaciones Nucleares (JINR) afirmó en 2007 que estaban considerando dos nombres para el nuevo elemento: Flyorium en honor de Gueorgui Fliórov, el fundador del instituto, y moskovium, en honor del óblast de Moscú donde está localizada Dubná.[57] También defendió que, aunque el elemento fue descubierto gracias a una investigación conjunta con científicos de Estados Unidos, que proporcionaron el californio necesario, el elemento debe llevar un nombre ruso, puesto que el Laboratorio Fliórov de Reacciones Nucleares en el JINR era la única instalación en todo el mundo en la que se podía conseguir la síntesis.[58][59]
El ununoctio fue renombrado como oganesón,[60] en honor al Profesor Yuri Oganesián. Su símbolo químico es Og.
Características
Estabilidad e isótopos
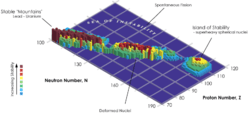
Ningún elemento con número atómico mayor de 83 tiene isótopos estables o tiene tiempos de desintegración observables. La estabilidad del núcleo atómico decrece con el aumento del número atómico, por lo que todos los elementos con más de 101 protones se desintegran radiactivamente con un periodo de semidesintegración inferior a un día.[61] Sin embargo, gracias a los «números mágicos», números enteros[62] de nucleones dispuestos en capa completa que aportan estabilidad extra a núcleos pesados,[63] la estabilidad nuclear aumenta en los elementos 110 a 114, dando lugar a lo que se conoce como «isla de estabilidad».[64] El concepto, propuesto por el estadounidense Glenn Seaborg de la Universidad de California en Berkeley, explica por qué los elementos transuránicos tienen una vida mayor de la esperada en términos teóricos.[65]
El oganesón es radiactivo y tiene un periodo de semidesintegración aparentemente menor al milisegundo, pero incluso este dato es mayor del predicho antes de su descubrimiento,[45][66] lo que parece apoyar la teoría de la «isla de estabilidad».[67] Como hemos visto, los cálculos realizados con un modelo de túnel cuántico predicen la existencia de bastantes isótopos ricos en neutrones del elemento 118, con periodos de semidesintegración cercanos al milisegundo y desintegración alfa.[41][42]
Los cálculos teóricos respecto a las rutas de síntesis propuestas para el oganesón muestran que algunos isótopos, como el 293Og, 295Og, 296Og, 297Og, 298Og, 300Og y 302Og pueden ser ligeramente más estables que el 294Og sintetizado hasta la fecha.[45][68] Entre estos, el 297Og es el que puede proporcionar un núcleo más estable.[45][68] Otros isótopos con más neutrones, como el 313Og, también pueden presentar núcleos ligeramente más estables.[69]
Propiedades físicas y atómicas calculadas

El oganesón, como elemento del grupo 18, presenta una valencia igual a cero. Los miembros de este grupo, denominados clásicamente gases nobles, presentan una baja reactividad porque su cubierta de electrones está llena con ocho electrones según la regla del octeto.[70] Esta cubierta completa produce una configuración de mínima energía en la que los electrones de valencia están firmemente adheridos.[71] Se supone que el oganesón, de forma similar, presenta una configuración electrónica 7s2, 7p6.[1]
Consecuentemente, se espera que el oganesón presente propiedades físicas y químicas similares al resto de elementos de su grupo, más concretamente semejantes a las del elemento superior en la tabla periódica, el radón.[72] Según las propiedades periódicas, el oganesón sería solo ligeramente más reactivo que el radón, pero los cálculos teóricos cuánticos realizados predicen que puede mostrar cierta reactividad en condiciones normales, por lo que no podría ser considerado un gas noble.[73] Además, el oganesón podría ser aún más reactivo que el copernicio y el flerovio.[74] La razón de este comportamiento puede basarse en la desestabilización energética de la capa de electrones por su gran número y la expansión radial según el campo espinorial de la capa 7p3/2.[1] Más concretamente, la interacción spin-órbita entre los electrones 7p con los electrones inertes 7s2 produce mayor estabilidad de la cubierta electrónica en el flerovio y un aumento significativo de la reactividad en el oganesón.[1]
También se ha calculado que el oganesón, al contrario que el resto de gases nobles,[75] muestra afinidad electrónica positiva, es decir, es capaz de capturar un electrón y formar un ion mononegativo con balance de energía positivo y, por lo tanto, aumenta su estabilidad.[76][77] Las correcciones de electrodinámica cuántica, sin embargo, han reducido la estabilidad del anión Og− en un 9%, por lo que la electroafinidad del oganesón será menor de la calculada inicialmente.[76]
Respecto a la polarizabilidad, se espera que el oganesón supere ampliamente el valor de todos los elementos con menor número atómico de la tabla periódica y que prácticamente duplique el valor de polarizabilidad del radón.[1] Por extrapolación de los datos de los otros gases nobles, el punto de ebullición del oganesón se situaría entre 320 y 380 K,[1] valores muy diferentes a los 263 K estimados por Glenn Seaborg[78] o los 247 K calculados en el año 2002.[79] Aún con esta incertidumbre, parece altamente improbable que el elemento 118 sea un gas en condiciones normales.[1] Debido a que la gama de estado líquido de los otros elementos de su grupo es muy limitada (entre 2 y 9 K),[80] este elemento debería ser sólido en condiciones normales. Si formara un gas, sería una de las sustancias gaseosas más densas, incluso siendo monoatómico como los otros gases nobles.[1]
Debido a este elevando valor de polarizabilidad, se supone que el oganesón presentará una energía de ionización anormalmente baja, similar a la del plomo, que es un 30% inferior a la del radón[81] y significativamente inferior a la del flerovio,[82] además de un estado estándar en fase condensada.[1]
Compuestos
A pesar de que no se ha sintetizado aún ningún compuesto de oganesón, se han realizado cálculos teóricos sobre su reactividad desde 1964.[52] El estado de oxidación más común será 0, como en el resto de gases nobles, suponiendo que la energía de ionización, que como se ha indicado será siempre reducida, sea lo suficientemente alta.[83]
Los cálculos realizados respecto a la molécula dímera Og2 muestran una energía de enlace= prácticamente equivalente a la del dimercurio (Hg2) y una energía de disociación de 6 kJ/mol, casi cuatro veces más que la del Rn2.[1] Más notable aún es el cálculo que afirma que el dímero presentará una longitud de enlace menor en 0,16 Å que el Rn2, lo que sería indicativo de un enlace fuerte.[1] Por otro lado, el compuesto OgH+ muestra teóricamente una energía de disociación, es decir, una afinidad protónica, menor que el RnH+.[1]
El enlace entre el oganesón y el hidrógeno en el OgH es muy débil y puede ser considerado más como una interacción de van der Waals que como un enlace químico.[81] Por otro lado, al ser un elemento con una alta electronegatividad, probablemente forme elementos más estables que el copernicio y el flerovio.[81] Se ha predicho la existencia de estados de oxidación estables +2 y +4 en los compuestos con flúor OgF2 y OgF4.[84] Estos estados son el resultado de las mismas interacciones spin-órbita que hacen del oganesón un elemento inusualmente reactivo. Por ejemplo, los cálculos indican que la reacción de Og con F2 para formar el compuesto OgF2 liberaría una energía de 106 kcal/mol, de las cuales 46 kcal/mol provienen de estas interacciones.[81] En comparación, la interacción spin-órbita del RnF2, una molécula muy similar a priori, es de cerca de 10 kcal/mol en un total de energía liberada de 49 kcal/mol.[81]
La misma interacción estabiliza la configuración tetraédrica Td en el OgF4, al contrario que la plano cuadrada D4h del XeF4 y el RnF4.[84] El enlace Og-F es probablemente iónico, no covalente, haciendo que los compuestos OgFn no sean volátiles.[4][85] Al contrario que el resto de elementos del grupo, el oganesón es teóricamente lo suficientemente electropositivo para formar un enlace Og-Cl con cloro.[4]
Ya que solo se han sintetizado tres o cuatro átomos de oganesón hasta la fecha, no se conocen las aplicaciones de sus compuestos más allá de la investigación científica. Por las características del elemento, la exposición a cualquiera de sus compuestos supondría un caso grave de envenenamiento por radiación.[86]
Notas
- El elemento ha sido sintetizado satisfactoriamente según los criterios de la IUPAC, si bien ningún laboratorio ha reproducido la síntesis del oganesón debido a la gran dificultad técnica que entraña. Cfr. Wapstra, A. H. (1991). «Criteria that must be satisfied for the discovery of a new chemical element to be recognized». Pure Appl. Chem. 63 (6): pp. 879-886. doi:10.1351/pac199163060879. Consultado el 28 de septiembre de 2009. y Kaesz, H. (marzo de 2002). «The Synthesis and Naming of Elements 110 and Beyond». Chemistry International 24 (2). Consultado el 28 de septiembre de 2009.
- Todos los isótopos predichos forman un sistema dinuclear. Cfr. Audi, G.; Wapstra, A. H., Thibault, C., Blachot, J. y Bersillon, O. (2003). «Ame2003 Atomic Mass Evaluation». Nuclear Physics. A729. Consultado el 28 de septiembre de 2009.
Referencias
- Clinton S. Nash (2005). «Atomic and Molecular Properties of Elements 112, 114, and 118». Journal of Physical Chemistry A 109 (15): 3493-3500. Consultado el 27 de septiembre de 2009.
- Glenn Theodore Seaborg (1994). Modern Alchemy. World Scientific. p. 172. ISBN 9810214405. Consultado el 27 de septiembre de 2009.
- «Ununoctium: Binary Compounds». WebElements Periodic Table. Consultado el 27 de septiembre de 2009.
- Uzi Kaldor, Stephen Wilson (2003). Theoretical Chemistry and Physics of Heavy and Superheavy Elements. Springer. p. 105. ISBN 140201371X. Consultado el 27 de septiembre de 2009.
- R. Eichler, B. Eichler, Thermochemical Properties of the Elements Rn, 112, 114, and 118, Paul Scherrer Institut, archivado desde el original el 25 de febrero de 2009, consultado el 27 de septiembre de 2009.
- Oganessian, Yu. Ts.; Utyonkov, V.K.; Lobanov, Yu.V.; Abdullin, F.Sh.; Polyakov, A.N.; Sagaidak, R.N.; Shirokovsky, I.V.; Tsyganov, Yu.S.; Voinov, Yu.S.; Gulbekian, G.G.; Bogomolov, S.L.; B. N. Gikal, A. N. Mezentsev, S. Iliev; Subbotin, V.G.; Sukhov, A.M.; Subotic, K; Zagrebaev, V.I.; Vostokin, G.K.; Itkis, M. G.; Moody, K.J; Patin, J.B.; Shaughnessy, D.A.; Stoyer, M.A.; Stoyer, N.J.; Wilk, P.A.; Kenneally, J.M.; Landrum, J.H.; Wild, J.H.; Lougheed, R.W. (10 de septiembre de 2006). «Synthesis of the isotopes of elements 118 and 116 in the 249Cf and 245Cm+48Ca fusion reactions». Physical Review C 74 (4): 044602. doi:10.1103/PhysRevC.74.044602. Consultado el 27 de septiembre de 2009.
- «Consulta: elementos químicos». Fundéu BBVA. 24 de noviembre de 2016.
- «Cuatro nuevos elementos químicos en la tabla periódica». diariomedico.com. 13 de julio de 2016.
- «Cuatro nuevos elementos en la tabla periódica». ABC. 9 de junio de 2016.
- Garritz, A.; Garritz Ruiz, A., Chamizo Guerrero, J. A. (2001). Tú y la química. Madrid: Pearson Educación. pp. pág. 341. ISBN 9789684444140.
- «IUPAC announces the verification of the discoveries of four new chemical elements: The 7th period of the periodic table of elements is complete» (en inglés). Consultado el 9 de junio de 2016.
- «Los cuatro nombres de los nuevos elementos de la tabla periódica». 2016. Consultado el 2016.
- «The Top 6 Physics Stories of 2006». Discover Magazine. 7 de enero de 2007. Archivado desde el original el 12 de octubre de 2007. Consultado el 27 de septiembre de 2009.
- Monastersky, Richard (16 de agosto de 2002). «Atomic Lies: How one physicist may have cheated in the race to find new elements». The Chronicle of Higher Education. Archivado desde el original el 8 de julio de 2010. Consultado el 27 de septiembre de 2009.
- Johnson, George (15 de octubre de 2002). «At Lawrence Berkeley, Physicists Say a Colleague Took Them for a Ride». The New York Times. Consultado el 27 de septiembre de 2009.
- Overbye, Dennis (19 de noviembre de 2002). «After Two Scandals, Physics Group Expands Ethics Guidelines». The New York Times. Consultado el 27 de septiembre de 2009.
- Robert Smolańczuk (mayo de 1999). «Production mechanism of superheavy nuclei in cold fusion reactions». Physical Review C 59 (5): 2634-2639. doi:10.1103/PhysRevC.59.2634.
- Antonio Jiménez (1999). Universidad Autónoma de Madrid, ed. «Ununoctium, ununoctio». Archivado desde el original el 14 de junio de 2009. Consultado el 12 de octubre de 2009. «ensayos realizados por el Lawrence Berkeley National Laboratory (LBNL), Berkeley, (California, USA), la Universidad de California y la Universidad del Estado de Oregón (Corvallis, USA) y basados en cálculos llevados a cabo por Robert Smolanczuk (Soltan Institute for Nuclear Studies, Polonia) sobre la fusión de núcleos atómicos, que sugerían que sería posible obtener el elemento 118 mediante fusión de plomo y kriptón empleando condiciones muy controladas.»
- S. B. Duarte, O. A. P. Tavares, M. Gonçalves, O. Rodríguez, F. Guzmán, T. N. Barbosa, F. García y A. Dimarco (2004). «Half-life predictions for decay modes of superheavy nuclei». Journal of Physics G: Nuclear and Particle Physic 30: 1487-1494. doi:10.1088/0954-3899/30/10/014. Consultado el 27 de septiembre de 2009.
- Feng, Zhao-Qing (2007). «Formation of superheavy nuclei in cold fusion reactions». Physical Review C 76: 044606. doi:10.1103/PhysRevC.76.044606.
- Feng, Z (2009). «Production of heavy and superheavy nuclei in massive fusion reactions». Nuclear Physics A 816: 33. doi:10.1016/j.nuclphysa.2008.11.003.
- Ninov, Viktor; K. E. Gregorich, W. Loveland, A. Ghiorso, D. C. Hoffman, D. M. Lee, H. Nitsche, W. J. Swiatecki, U. W. Kirbach, C. A. Laue, J. L. Adams, J. B. Patin, D. A. Shaughnessy, D. A. Strellis, and P. A. Wilk (1999). «Observation of Superheavy Nuclei Produced in the Reaction of 86Kr with 208Pb». Physical Review Letters 83: 1104-1107. doi:10.1103/PhysRevLett.83.1104.
- Robert F. Service (1999). «Berkeley Crew Bags Element 118». Science 284: 1751. doi:10.1126/science.284.5421.1751.
- Antonio Jiménez (1999). Universidad Autónoma de Madrid, ed. «Posible síntesis del ununoctio». Archivado desde el original el 16 de agosto de 2011. Consultado el 12 de octubre de 2009.
- Antonio Jiménez (1999). Universidad Autónoma de Madrid, ed. «Ciclotrón de 88 pulgadas del LBNL en la síntesis del Uuo». Archivado desde el original el 16 de agosto de 2011. Consultado el 12 de octubre de 2009.
- Antonio Jiménez (1999). Universidad Autónoma de Madrid, ed. «Esquema del dispositivo de separación en la síntesis del Uuo». Archivado desde el original el 16 de agosto de 2011. Consultado el 12 de octubre de 2009.
- Public Affairs Department (21 de julio de 2001). «Results of element 118 experiment retracted». Berkeley Lab. Archivado desde el original el 29 de enero de 2008. Consultado el 27 de septiembre de 2009.
- Dalton, Rex (2002). «Misconduct: The stars who fell to Earth». Nature 420: 728-729. doi:10.1038/420728a.
- Dalton, R (27 de julio de 2001). «Results of Element 118 Experiment Retracted» (6917). Berkeley Lab News. PMID 12490902. Archivado desde el original el 29 de enero de 2008. Consultado el 27 de septiembre de 2009.
- Yu. Ts. Oganessian et al. (2002). «Results from the first 249Cf+48Ca experiment». JINR Communication (en ruso) (JINR, Dubna).
- Oganessian Yu.Ts. et al. (2002). «Element 118: results from the first 294Cf + 249Ca experiment». JINR Publishing Department. Archivado desde el original el 3 de julio de 2011. Consultado el 27 de septiembre de 2009.
- «Livermore scientists team with Russia to discover element 118». Livermore press release. 3 de diciembre de 2006. Archivado desde el original el 27 de mayo de 2010. Consultado el 27 de septiembre de 2009.
- Yu. Ts. Oganessian (2006). «Synthesis and decay properties of superheavy elements». Pure Appl. Chem. 78: 889-904. doi:10.1351/pac200678050889.
- Katharine Sanderson (2006). «Heaviest element made - again». Nature News (Nature). doi:10.1038/news061016-4.
- Phil Schewe; Ben Stein (17 de octubre de 2006). «Elements 116 and 118 Are Discovered». Physics News Update. American Institute of Physics. Archivado desde el original el 17 de agosto de 2009. Consultado el 27 de septiembre de 2009.
- Rick Weiss (17 de octubre de 2006). «Scientists Announce Creation of Atomic Element, the Heaviest Yet». Washington Post. Consultado el 27 de septiembre de 2009.
- «Ununoctium». WebElements Periodic Table. Consultado el 27 de septiembre de 2009.
- «Element 118 Detected, With Confidence». Chemical and Engineering news. 17 de octubre de 2006. Consultado el 27 de septiembre de 2009. «I would say we're very confident.»
- P. Roy Chowdhury, C. Samanta, and D. N. Basu (2006). «α decay half-lives of new superheavy elements». Physical Reviews C 73: 014612. doi:10.1103/PhysRevC.73.014612.
- C. Samanta, P. Roy Chowdhury and D.N. Basu (2007). «Predictions of alpha decay half lives of heavy and superheavy elements». Nucl. Phys. A 789: 142-154. doi:10.1016/j.nuclphysa.2007.04.001.
- P. Roy Chowdhury, C. Samanta, and D. N. Basu (2008). «Search for long lived heaviest nuclei beyond the valley of stability». Physical Reviews C 77: 044603. doi:10.1103/PhysRevC.77.044603.
- P. Roy Chowdhury, C. Samanta, and D. N. Basu (2008). «Nuclear half-lives for α -radioactivity of elements with 100 ≤ Z ≤ 130». At. Data & Nucl. Data Tables 94: 781-806. doi:10.1016/j.adt.2008.01.003.
- Oganessian, Yu. Ts.; Utyonkov, V.K.; Lobanov, Yu.V.; Abdullin, F.Sh.; Polyakov, A.N.; Sagaidak, R.N.; Shirokovsky, I.V.; Tsyganov, Yu.S.; Voinov, Yu.S.; Gulbekian, G.G.; Bogomolov, S.L.; B. N. Gikal, A. N. Mezentsev, S. Iliev; Subbotin, V.G.; Sukhov, A.M.; Subotic, K; Zagrebaev, V.I.; Vostokin, G.K.; Itkis, M. G.; Moody, K.J; Patin, J.B.; Shaughnessy, D.A.; Stoyer, M.A.; Stoyer, N.J.; Wilk, P.A.; Kenneally, J.M.; Landrum, J.H.; Wild, J.H.; Lougheed, R.W. (2006). «Synthesis of the isotopes of elements 118 and 116 in the 249Californium and 245Curium + 48Calcium fusion reactions». Physical Review C 74 (4): 044602. doi:10.1103/PhysRevC.74.044602.
- Cramer, Christopher J. (2004). Essentials of computational chemistry: theories and models (en inglés) (2ª edición). John Wiley and Sons. ISBN 9780470091821.
- P. Roy Chowdhury, C. Samanta, and D. N. Basu (26 de enero de 2006). «α decay half-lives of new superheavy elements». Physical Reviews C 73: 014612. doi:10.1103/PhysRevC.73.014612.
- B.R. Martin and G. Shaw (2007). Particle Physics. John Wiley & Sons. p. 34. ISBN 0-471-97285-1.
- K.S. Krane (1988). Introductory Nuclear Physics. John Wiley & Sons. p. 381. ISBN 047180553X.
- Yu. Ts. Oganessian et al. (2004). «Measurements of cross sections and decay properties of the isotopes of elements 112, 114, and 116 produced in the fusion reactions 233, 238U, 242Pu, and 248Cm+48Ca». Physical Reviews C 70: 064609. doi:10.1103/PhysRevC.70.064609.
- «A New Block on the Periodic Table». Lawrence Livermore National Laboratory. abril de 2007. Archivado desde el original el 28 de mayo de 2008. Consultado el 27 de septiembre de 2009.
- Oganessian et al. (2009). «Attempt to produce element 120 in the 244Pu+58Fe reaction». Physical Reviews C 79: 024603. doi:10.1103/PhysRevC.73.014612.
- Agafoshin, N. P. (2008). Ley periódica y sistema periódico de los elementos de Mendeleiev. Barcelona: Reverté. pp. pág. 23. ISBN 9788429170214.
- A. V. Grosse (1965). «Some physical and chemical properties of element 118 (Eka-Em) and element 86 (Em)». Journal of Inorganic and Nuclear Chemistry (Elsevier Science Ltd.) 27 (3): 509-19. doi:10.1016/0022-1902(65)80255-X.
- Costa, J. M. (2005). Diccionario de química física. Madrid: Ediciones Díaz de Santos. ISBN 9788479786915.
- J. Chatt (1979). «Recommendations for the Naming of Elements of Atomic Numbers Greater than 100». Pure Appl. Chem. 51: 381-384. doi:10.1351/pac197951020381.
- Koppenol, W. H. (2002). «Naming of new elements (IUPAC Recommendations 2002)». Pure Appl. Chem. 74 (5): pp. 787-791. doi:10.1351/pac200274050787. Consultado el 28 de septiembre de 2009.
- «Discovery of New Elements Makes Front Page News». Berkeley Lab Research Review Summer 1999. 1999. Consultado el 27 de septiembre de 2009.
- «New chemical elements discovered in Russia`s Science City». 12 de febrero de 2007. Consultado el 27 de septiembre de 2009.
- NewsInfo (2006). «Periodic table has expanded» (en ruso). Rambler. Consultado el 27 de septiembre de 2009.
- Yemel'yanova, Asya (2006). «118th element will be named in Russian» (en ruso). vesti.ru. Consultado el 27 de septiembre de 2009.
- «IUPAC is naming the four new elements nihonium, moscovium, tennessine, and oganesson» (en inglés). Consultado el 17 de octubre de 2020.
- Cook, Norman D. (2006). Models of the Atomic Nucleus (en inglés). Nueva York: Springer. ISBN 9783540285694.
- Mason Inman (14 de diciembre de 2006). «A Nuclear Magic Trick». Physical Review Focus. Consultado el 3 de octubre de 2009.
- «Shell Model of Nucleus». HyperPhysics. Department of Physics and Astronomy, Georgia State University. Consultado el 28 de septiembre de 2009.
- Glenn D Considine; Peter H Kulik (2002). Van Nostrand's scientific encyclopedia (9 edición). Wiley-Interscience. ISBN 9780471332305. OCLC 223349096.
- Yuri Oganessian (2007). «Heaviest nuclei from 48Ca-induced reactions». Journal of Physics G: Nuclear and Particle Physics 34: R165-R242. doi:10.1088/0954-3899/34/4/R01.
- «New Element Isolated Only Briefly». The Daily Californian. 2006. Archivado desde el original el 8 de octubre de 2008. Consultado el 27 de septiembre de 2009.
- G. Royer, K. Zbiri, C. Bonilla (2004). «Entrance channels and alpha decay half-lives of the heaviest elements». Nuclear Physics A 730: 355-376. doi:10.1016/j.nuclphysa.2003.11.010.
- S B Duarte, O A P Tavares, M Gonçalves, O Rodríguez, F Guzmán, T N Barbosa, F García and A Dimarco (2004). «Half-life predictions for decay modes of superheavy nuclei». Journal of Physics G: Nuclear and Particle Physics 30: 1487-1494. doi:10.1088/0954-3899/30/10/014.
- Greenwood, N. N.; Earnshaw, A. (1997). Chemistry of the Elements (2nd edición). Oxford:Butterworth-Heinemann. ISBN 0-7506-3365-4.
- Bader, Richard F.W. «An Introduction to the Electronic Structure of Atoms and Molecules». McMaster University. Consultado el 27 de septiembre de 2009.
- «Ununoctium (Uuo) - Chemical properties, Health and Environmental effects». Lenntech. Archivado desde el original el 16 de enero de 2008. Consultado el 27 de septiembre de 2009.
- Uzi Kaldor, Stephen Wilson (2003). Theoretical Chemistry and Physics of Heavy and Superheavy Elements. Springer. p. 105. ISBN 140201371X.
- Clinton S. Nash (2005). «Atomic and Molecular Properties of Elements 112, 114, and 118». Journal of Physical Chemistry A 109 (15): 3493-3500. PMID 16833687. doi:10.1021/jp050736o.
- Wheeler, John C. (1997). «Electron Affinities of the Alkaline Earth Metals and the Sign Convention for Electron Affinity». Journal of Chemical Education 74: 123-127.
- Igor Goidenko, Leonti Labzowsky, Ephraim Eliav, Uzi Kaldor, and Pekka Pyykko (2003). «QED corrections to the binding energy of the eka-radon (Z=118) negative ion». Physical Review A 67: 020102(R). doi:10.1103/PhysRevA.67.020102.
- Ephraim Eliav and Uzi Kaldor (1996). «Element 118: The First Rare Gas with an Electron Affinity». Physical Review Letters 77 (27): 5350. doi:10.1103/PhysRevLett.77.5350.
- Glenn Theodore Seaborg (1994). Modern Alchemy. World Scientific. p. 172. ISBN 9810214405.
- N. Takahashi (2002). «Boiling points of the superheavy elements 117 and 118». Journal of Radioanalytical and Nuclear Chemistry 251 (2): 299-301. doi:10.1023/A:1014880730282.
- Kalcher, Josef; Sax, Alexander F. (1994). «Gas Phase Stabilities of Small Anions: Theory and Experiment in Cooperation». Chemical Reviews 94: 2291-2318. doi:10.1021/cr00032a004.
- Young-Kyu Han, Cheolbeom Bae, Sang-Kil Son, and Yoon Sup Lee (2000). «Spin–orbit effects on the transactinide p-block element monohydrides MH (M=element 113-118)». Journal of Chemical Physics 112 (6): 2684. doi:10.1063/1.480842.
- Clinton S. Nash (1999). «Spin-Orbit Effects, VSEPR Theory, and the Electronic Structures of Heavy and Superheavy Group IVA Hydrides and Group VIIIA Tetrafluorides. A Partial Role Reversal for Elements 114 and 118». Journal of Physical Chemistry A 1999 (3): 402-410. doi:10.1021/jp982735k.
- «Ununoctium: Binary Compounds». WebElements Periodic Table. Consultado el 27 de septiembre de 2009.
- Young-Kyu Han and Yoon Sup Lee (1999). «Structures of RgFn (Rg = Xe, Rn, and Element 118. n = 2, 4.) Calculated by Two-component Spin-Orbit Methods. A Spin-Orbit Induced Isomer of (118)F4». Journal of Physical Chemistry A 103 (8): 1104-1108. doi:10.1021/jp983665k.
- Kenneth S. Pitzer (1975). «Fluorides of radon and element 118». =Journal of the Chemical Society, Chemical Communications: 760-761. doi:10.1039/C3975000760b.
- «Ununoctium: Biological information». WebElements Periodic Table. Consultado el 27 de septiembre de 2009.
Enlaces externos
- Esta obra contiene una traducción total derivada de «Oganesson» de la Wikipedia en inglés, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 3.0 Unported.
 Wikimedia Commons alberga una categoría multimedia sobre Oganesón.
Wikimedia Commons alberga una categoría multimedia sobre Oganesón.- El elemento 118, el más pesado hasta ahora, apareció durante una milésima de segundo
- WebElements: Oganesson (en inglés).
- It's Elemental: Oganesson (en inglés).